Welcome message from author
This document is posted to help you gain knowledge. Please leave a comment to let me know what you think about it! Share it to your friends and learn new things together.
Transcript


Resumen
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
Resumen. El Parthenium hysterophorus, Linn (escoba amarga) constituye una planta
empleada desde la antigüedad en el tratamiento de diversas patologías,
dentro de las cuales se destaca la antiparasitaria. La experiencia de
laboratorio desarrollada en la investigación, propone una metodología
extractiva con un mínimo de interferencias y la caracterización estructural
preliminar a través de técnicas espectroscópicas de su principal constituyente
sesquiterpenoide activo, la partenina, con vistas a su utilización como
patrón de análisis, atendiendo a su no comercialización en el mercado
internacional. El reconocimiento cualitativo del componente principal fue
desarrollado a través de la Cromatografía en Capa Delgada (CCD) bajo las
condiciones cromatográficas reportadas en la literatura especializada. Se
desarrolla y valida la Cromatografía Líquida de Alta Eficacia (CLAE) para
la determinación de partenina en los sólidos pulverulentos de la planta,
aplicables en el control de la calidad, estudios de estabilidad del sólido
pulverulento y futuras formas de dosificación sólidas orales. La técnica
cromatográfica de análisis (CLAE) es lineal, precisa, exacta, específica y
sensible. La determinación cuantitativa de partenina en los sólidos
pulverulentos de la planta aporta un 4.71 % de acuerdo a las condiciones
experimentales establecidas.

Indice
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
Indice Pág. Introducción……………………………………………………….................1 Capítulo I. Revisión Bibliográfica…………………………………...........3 I.1- Monografía del Parthenium hysterophorus, Linn (escoba amarga)..................3 I.1.1- Nombres vernáculos................................................................................3 I.1.2- Origen y distribución geográfica de la planta..........................................3 I.1.3- Descripción botánica................................................................................3 I.1.4- Composición química de la planta. Generalidades..................................4 I.1.5- Usos en la medicina tradicional………………………………………...5 I.1.6- Propiedades químicas y físicas de la partenina, ingrediente activo principal……………………………………………………………..….6 I.1.6.1- Métodos de aislamiento y purificación………………………….….8 I.1.6.1.1- Extracción por ultrasonido y su aplicación en muestras vegetales. (Sonificación)……………………………………...10 I.2- Consideraciones analíticas………………………………………………......12 I.2.1- Monografía analítica de Tanacetum parthenium, perteneciente a la familia Asteraceae…………………………………………………....12 I.2.2- Consideraciones generales referentes a técnicas cromatográficas aplicadas al análisis de lactonas sesquiterpénicas…............................14 I.2.3- Métodos analíticos aplicados a las estructuras sesquiterpenoides..........15 I.2.4- Cromatografía de Capa Delgada (CCD).................................................16 I.2.4.1- Separación y análisis cromatográfico de lactonas sesquiterpénicas………………………………………………...….16 I.2.5- Reactivos de comprobación empleados en Cromatografía de Capa Delgada (CCD)…………………………………...…………………....18 I.2.6- Cromatografía Líquida de Alta Eficacia (CLAE)...................................19 I.2.7- CLAE con detección UV.........................................................................21 I.3- Validación de técnicas de análisis.....................................................................22 I.3.1- Linealidad................................................................................................22 I.3.2- Precisión …………………………………………………………….....27 I.3.3- Exactitud …………………………………………………………….…29 I.3.4- Especificidad ……………………………………………………….….31 I.3.5- Sensibilidad …………………………………………………………....31 I.4- Métodos espectroscópicos para la elucidación estructural …………………..32

Indice
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
Capítulo II. Materiales y Métodos.............................................................33 II.1- Recolección, secado y molinado del material vegetal.......................................33 II.2- Metodología de extracción del componente de interés (partenina) ..................34 II.3- Aislamiento y caracterización estructural preliminar del componente de interés terapéutico (partenina) con vistas a su utilización como patrón analítico………………………………………………………………………..34 II.4- Desarrollo y validación de tecnicas analíticas ...................................................35 II.4.1- Determinación cuantitativa de partenina en extracto de hojas de Parthenium hysterophorus, L. mediante Cromatografía Líquida de Alta Eficacia (CLAE)……………………………………………….35 II.4.2- Validación de la técnica analítica de Cromatografía Líquida de Alta Eficacia (CLAE) para la cuantificación de partenina en el extracto vegetal…………………………………………………………41 II.4.2.1- Linealidad.........................................................................................41 II.4.2.2- Precisión...........................................................................................42 II.4.2.3- Exactitud..........................................................................................44 II.4.2.4- Especificidad....................................................................................45 II.4.2.5- Sensibilidad......................................................................................45 Capítulo III. Análisis y Discusión de los Resultados..............................47 III.1- Metodología de extracción para la obtención de partenina……………….….47 III.2- Aislamiento y caracterización estructural de la partenina…………….. .........47 III.3- Desarrollo y validación de técnicas analíticas..................................................50 III.3.1- Desarrollo y validación de la técnica analítica para la deter- minación cuantitativa de partenina en extractos de Parthenium hysterophorus, L.mediante Cromatografía Líquida de Alta Eficacia (CLAE)………………………………………….………......50 III.3.1.1- Linealidad……………………………………………….…..…...50 III.3.1.2- Precisión……………………………………………….………...52 III.3.1.3- Exactitud…………………………………………………............57 III.3.1.4- Especificidad…………………………………………….............58 III.3.1.5- Sensibilidad………………………………………………...........60 Conclusiones............................................................................................62 Recomendaciones....................................................................................63 Bibliografía..............................................................................................64 Anexos

Introducción
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
1
Introducción. En los últimos años, el estudio y utilización de las plantas medicinales han
tomado un notable auge. Desde tiempos inmemorables, ellas constituyeron
el principal arsenal terapéutico del hombre. A mediados del siglo XIX,
debido al desarrollo alcanzado por la síntesis de productos orgánicos, estas
comienzan a ser relegadas a un segundo plano, pero siempre han
representado una parte considerable en las fuentes de materia prima para la
fabricación de medicamentos. El Parthenium hysterophorus, Linn.
conocida comúnmente como escoba amarga es usada ampliamente por la
población como antipirético, antiparasitario (amebicida y antihelmíntica) y
en el tratamiento de afecciones de la piel, aunque carece de una forma
farmacéutica definida con este propósito.
Teniendo en consideración la necesidad de estudios analíticos y tecnológicos
que permitan obtener una forma de dosificación científicamente
fundamentada, en el Departamento de Farmacia de la UCLV se trabaja en el
diseño y evaluación de una forma farmacéutica oral que contenga el sólido
pulverulento de la planta, lo que justifica que la presente investigación se
proponga desarrollar una técnica analítica que permitirá realizar el control de
la calidad, la estabilidad del polvo y de futuras formas de dosificación.

Introducción
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
2
Atendiendo a la no comercialización a escala internacional de la partenina,
patrón de análisis aplicable en la estimación de su contenido, en el presente
estudio nos hemos propuesto desarrollar una metodología extractiva para su
aislamiento a partir de los sólidos pulverulentos de la planta. El
establecimiento de la monografía analítica del polvo obtenido a partir del
Parthenium hysterophorus, Linn. conlleva a la validación de un método
analítico fiable en la determinación de su principal lactona sesquiterpénica,
la partenina.
Para concretar los antecedentes referidos, planteamos los siguientes
objetivos:
Establecer la metodología de aislamiento de la partenina, a partir de
los sólidos pulverulentos de la planta, con vistas a su utilización como
patrón analítico.
Caracterizar mediante la Cromatografía en Capa Delgada (CCD), la
resonancia protónica y C13 al producto obtenido.
Desarrollar y validar la Cromatografía Líquida de Alta Eficacia
(CLAE) para la determinación cuantitativa de la partenina en los
sólidos pulverulentos de Parthenium hysterophorus, Linn.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
3
Capítulo I. Revisión Bibliográfica.
I.1- Monografía del Parthenium hysterophorus, Linn (escoba amarga). I.1.1- Nombres vernáculos. Escoba amarga , artemisa, artemisilla, confitillo, manzanilla, ajenjo cimarrón, yerba
de la oveja, santa maría, yerba amarga, feverfew, mugwort, bitler weed, congress
grass, congres Weed, botonera y altamiski. [1, 2]
I.1.2- Origen y distribución geográfica de la planta.
La escoba amarga es nativa de América tropical y fue introducida en África, Asia y
Oceanía en cargamentos de cereales y semillas de pastos provenientes de los EE.UU.
durante la década de los 1950.
Está ampliamente diseminada en pastos, huertos de árboles frutales y áreas
cultivables sobre suelos neutros y ácidos. En India, la maleza es considerada un
problema grave (Gupta y Sharma 1977; Shelke 1984); en América Central y el
Caribe, la escoba amarga aparece principalmente en áreas repetidamente tratadas con
paraquat o con ciertos herbicidas activos en el suelo y utilizados selectivamente en
hortalizas y leguminosas, tales como trifluralin, difenamida y otra (Labrada 1990).[3]
I.1.3- Descripción botánica.
Pertenece a la familia Compositae o Asteraceae, es una planta erecta anual con hojas
alternas, profundamente disecadas, que crece hasta 2 m de altura con inflorescencias
ramificadas que portan cabezuelas florales blancas y aquenios negros, obovoides y
suaves.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
4
Las hojas alternas, dentadas, o partidas, de contorno aovado a oblongo, 1-2
pennadas, partidas en segmentos lineales o lancelados, o pinatífidas, delgadas y
flácidas que pueden medir hasta 10 cm. de largo y 5 cm. de ancho. Flores dimorfas,
de 5-6 mm de ancho, las marginales femeninas, generalmente 3-3 tubulosa con
limbo tetralobulado y estilo de ramas cortas; hermafroditas, unas 5 tubulosas
tetrámeras, ánteras, cortamente sagitadas en su base, estilo truncado en su ápice.
Fruto aquenio, piloso cilíndrico, papus coroniformes con 8-10 aristas desiguales. [1, 4,
5]
I.1.4- Composición química de la planta. Generalidades.
Las lactonas sesquiterpénicas presente en la planta son: partenina, himenina,
coronofilina, damsina, ambrosina, hysterina, caryofilina y monoterpenos como
limonero y pineno. [6, 7, 8]
Las hojas poseen esteroides como campesterol, estigmasterol, β – citosterol,
derivados de flavonoides como la quercetina, quercitrina, quercetagetina y
kaempherol. [9, 10]
Además contiene otros elementos como alcaloides, carbohidratos, alcanos, lípidos,
aceites esenciales y compuestos inorgánicos como son: Ca, Fe, Mn, Cu, Zn, K, Na,
Mg, Cd y Pb. [10, 11]
Debido a la gran diversidad estructural de las sesquiterpenlactonas, no se cuenta con
unas normas claras para su nomenclatura, por esto se acostumbra denominarlas con
nombres vulgares p.ej. Helenalina, Mexicanina, Artemisinina; aunque algunos
autores las nombran relacionando el núcleo básico y los sustituyentes.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
5
Son sustancia amargas, se encuentran en todas las partes de la planta, en
concentraciones que varían entre 0.01 y 8 % del peso seco; las concentraciones
mayores se encuentran generalmente en las hojas; son bastante solubles en
cloroformo y en éter etílico y de gran importancia por la variada acción biológica
que han demostrado: acción citotóxica, antitumoral, analgésica, inhibidores del
crecimiento de bacterias, entre otros. [10]
Son compuestos amargos y difíciles de saponificar; se caracterizan por dar
coloración púrpura cuando se tratan con solución de clorhidrato de hidroxilamina en
metanol y KOH en metanol; se calientan a ebullición y después de enfriar; se tratan
con cloruro férrico (reacción de hidroxamatos para ésteres y lactonas). La reacción
de Legal es característica de lactonas insaturadas, las cuales producen coloración
rosada. [12, 13]
I.1.5- Usos en la medicina tradicional.
El Parthenium hysterophorus, Linn (escoba amarga) es amarga, corroborante y
febrífuga. En cocimiento es ideal contra el paludismo, usada en forma externa es ideal
para herpes, sarnas y tiña. [14]
Esta planta tiene cierta reputación en la medicina folklórica y ha sido usada por
aztecas, indios y otras naciones de Norteamérica como remedio contra varias
afecciones. Las lactonas sesquiterpénicas son constituyentes característicos de esta
planta, la partenina, su principal componente, es el responsable de la actividad
biológica; mostrando efectos citotóxicos, antitumorales, antibióticos sobre bacterias y
hongos, antiparasitario. [15].

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
6
La etnofarmacología le otorga a sus infusiones actividades febrífugas, emolientes,
vulnerarias y sus tricomas pueden producir dermatitis. [14].
En Cuba se usa contra la fiebre y el acné juvenil; el cocimiento de la raíz es
antipalúdico; según Gómez de la Maza tiene propiedades antineurálgicas. [15].
Grosourdy, la considera tónico y estimulante estomacal. Además el zumo es útil
contra las úlceras tuberculosas y sifilíticas. [11]
Ha sido empleado en cocimientos para el corazón, pero en estudios para la evaluación
farmacológica de diferentes plantas, incluyendo la escoba amarga, se demostró
aplicando a cobayos un extracto a una concentración de 20 g en 100 ML de agua, la
ausencia de efectos sobre este órgano. [4]
Además se le atribuyen otra acciones como analgésica, antiartrítica, afecciones del
vaso, hígado, sistema nervioso, antidiabético, como antídoto, antiemética,
antiprurítica, para las afecciones del aparato respiratorio, en la gastritis, hipotensora,
tónico capilar, antiparasitaria, acelera el parto, regulador menstrual, antifúngica,
vermífuga y se usa en caso de disfonía y sinusitis. [15, 16]
I.1.6- Propiedades químicas y físicas de la partenina, ingrediente
activo principal.
Formula global: C15 H18 O4.
Peso Molecular: 262.305

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
7
Composición: C 68.69%; H6.92%; O 24.40%
Punto de Fusión: Mp 163-166º
Rotación Óptica: [α]25D + 7.02 (c, 2.71 en CHCl3)
Solubilidad: Sol. MeOH, CHCl3; poco sol. H2O
UV: [neutral] λmáx 215 (ε 13100); 340 (ε 20) (MeOH)
Otros datos: Farmacología: Isómero activo.
Importancia/Uso biológico: Bloqueador adrenérgico. Agente antineoplásico,
depresor SNC. Posee actividad antimalárica y antiauxina.
Fuente Biológica: Principio amargo de Parthenium hysterophorus e Iva nevadensis.
Reacciones adversas y Toxicidad: Su contacto puede causar dermatitis. LD50 (rat,
ipr) 42 mg/kg [17, 18]
Estructura química: [19]
O
O
O
HO
6a -H i drox i -6,9a-d i m eti l -3 -m etilen-3,3a,4,5,6,6a,9a,9b-octahidro-azuleno[4 ,5-b ]f u r an-2, 9-diona
(Partenina)

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
8
Es soluble en cloroformo, etanol, metanol, acetona, y ácido acético e insoluble en
hexano, heptano, benceno, tolueno, xileno y amoníaco. Su punto de fusión es de
163-166 0c, así como α= +7. [20]
I.1.6.1- Métodos de aislamiento y purificación. Nogueiras, C. reporta que para el aislamiento de partenina, se toman 30.0 g de
material vegetal y se realiza extracción Soxhlet continua por 3 horas con metanol. El
extracto se concentra hasta la mitad del volumen y se añade igual cantidad de agua,
en caso de obtener un residuo sólido, se filtra y la solución resultante se extrae tres
veces sucesivas con 15 mL de tolueno, posteriormente seis veces con 20 mL de
cloroformo, obteniéndose un extracto concentrado. Este extracto es pasado, para su
limpieza por columna cromatográfica de sílica gel, preparada por el método húmedo.
La elusión se realiza con n-heptano-acetato de etilo (1:1). Se realiza una
cromatografía en capa preparativa tomándose las fracciones de idéntico Rf las que
fueron recristalizadas en una mezcla de acetona-metanol. pf= 163 ºC.
El espectro IR realizado en pastillas de KBr, muestra bandas características de una γ-
lactona α-β insaturada. Debido a la presencia de dobles enlaces presentan bandas
pertenecientes a vibraciones de valencia νC=O 1755 cm-1 y νC-O 1408 cm-1. Una
banda intensa a 3450 cm-1 debido a la presencia de grupos hidroxilos. La existencia
de vibraciones de valencia νC-H pertenecientes a carbonos con hibridación sp2,
aparece a 2980 cm-1. El espectro IR en cloroformo muestra bandas a 3400, 3065,
1740, 1718, 1640, 1598, 890 y 820 cm-1. [20, 21]

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
9
Espectro UV (cloroformo): Presenta una banda de absorción en 215 nm de origen (π-
π*), como es conocido de compuestos que contiene un grupo C=O conjugado a un
grupo etileno (enona). El espectro de las enonas se caracteriza por una intensa banda
(π-π*) en la región de 215-250 nm, cuyo valor de coeficiente de extinción molar está
usualmente entre 10 000 y 20 000 y una banda débil (n-π*) entre 310-330 nm. En
ambas bandas hay presente un grupo C=O, polar, y por tanto la posición de cada uno
dependerá del tipo de solvente. La banda (π-π*) de la enona conduce a un
corrimiento batocrómico con el aumento de la polaridad del solvente. [22]
Espectro RMN: protones vinílicos (doblete a 7.665 ppm J= 5.88 y el otro a 6.14
ppm J= 5.87) correspondientes a protones de C-2 y C-13 respectivamente, ambos
asociados con el sistema ciclopentanona. Aparece dobletes a protones C-13 a 6.25
ppm (T= 2.63 y 5.62 ppm J= 2.26) los que explican la presencia de una γ-lactona
conjugada con un grupo metilen- hexocíclico. La señal del protón en C-6 aparece
con un doblete muy desblindado a 5.04 ppm, por estar unido a un heteroátomo en
efecto desblindante.
Marchand, B y Rodríguez, E. plantean tomar 100.0 g de material vegetal y extraer en
500 mL de cloroformo usando una máquina sacudidora por 5 minutos, se filtra y el
filtrado es evaporado y disuelto en 100mL de metanol. La suspensión fue filtrada por
miliporo. [7]
El componente partenina cristaliza parcialmente de la fracción clorofórmica luego de
evaporar el solvente. La recristalización con acetona-hexano da partenina en forma
de cristales incoloros, reportándose una temperatura de fusión de 163-166 0C Y
{α}25 = + 23.3 0. La caracterización por espectroscopía IR expresa bandas en

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
10
cloroformo a Vmáx 3600-3400 (OH), 2920-2890 (CH), 1760 (γ–lactona insaturada),
1730-1660 (ciclopentanona), 1408 (C=C), 1000 cm -1 (C-0-). [23]
Según Domínguez, E. la partenina puede ser extraída con cloroformo durante 24
horas chequeando su presencia por cromatografía de capa fina contra patrón en placa
de sílica gel usando como fase móvil benceno-acetona (4:1) detectándose la mancha
al exponerse a vapores de yodo a un Rf = 0.57. [24, 25]
Ranjit, S. Dhillon reporta el aislamiento usando 250 g de la partes aérea de la planta
seca y pulverizada mediante una extracción soxhlet con cloroformo por 10 horas,
rindiendo 9,0 g de aceite crudo, después de remover el pigmento verde. [21]
La cromatografía en columna sobre sílica gel proporciona 4,2 g (1,7 %) de partenina
visualizada como una mancha amarilla en CCF (agente revelador: 10 mL de etanol,
3 mL de ácido sulfúrico (conc), 1 mL de ácido acético glacial, 0.01 g de vainillina).
La partenina fue cristalizada en una mínima cantidad de etanol seguido de la
adicción de una mezcla (1:4) v/v de éter-hexano hasta turbidez lechosa, con posterior
refrigeración por 2 horas. El procedimiento anterior, proporciona cristales finos de
partenina con temperatura de fusión de 161 0c, la caracterización IR en cloroformo
muestra bandas a Vmáx de 3400, 3065, 1740, 1718, 1640, 1628, 890, 820 cm -1. [21]
I.1.6.1.1- Extracción por ultrasonido y su aplicación en muestras vegetales. (Sonificación)
El ultrasonido es un proceso que utiliza la energía de ondas sonoras que son
trasmitidas en frecuencia superior a la capacidad auditiva del oído humano. Estas

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
11
ondas sonoras crean una variación en la presión del líquido generando cavitación.
Esta ciencia puede ser dividida en dos principales áreas: alta y baja potencia.
Las ondas ultrasónicas de alta potencia (20-100 KHz) causan cambios físicos y
químicos permanentes, porque producen cavitación y microflujos en los líquidos,
calentamientos y rupturas en los sólidos e inestabilidad en la superficie de la interfase
de sistemas liquido-liquido y liquido-gas. Se caracteriza por la alta frecuencia, tras
locaciones pequeñas, velocidad moderada y alta aceleración.
Como método de extracción sólido-liquido, aplicado a los productos naturales, se han
encontrado pocas referencias, se emplea como método de extracción de antioxidantes
naturales, comparando este método de extracción con el fluidos supercríticos.
La eficiencia de extracción usando esta técnica, se cita como mejor o igual que la
obtenida con el extractor Soxhlet y se emplea como ventaja, la alta reproducibilidad,
la posibilidad de utilización para una amplia gama de tamaños de muestra y el bajo
costo.
En el método de extracción por ultrasonido se tienen en cuenta algunos parámetros
influyentes en el proceso: Tiempo de extracción, polaridad del disolvente, cantidad de
muestra, tamaño de partícula, relación masa-droga/volúmen de disolvente.
Dentro de las ventajas de este método tenemos que:
• Existe una relación proporcional entre el tiempo de extracción y el rendimiento,
condición que se cumple también para otros métodos de extracción sólido-
liquido.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
12
• A mayor polaridad, mayor rendimiento, lo que puede estar determinado por la
naturaleza de los metabolitos secundarios presentes, aunque no se debe descartar
que en este método las ondas ultrasónicas se trasmiten en el disolvente y puede
verse favorecida por la polaridad del disolvente.
• Para este método de extracción resulta más conveniente emplear el mayor tiempo
de extracción, la mayor polaridad y la relación masa disolvente, para obtener los
mejores rendimientos. [26]
I.2- Consideraciones analíticas. I.2.1- Monografía analítica de Tanacetum parthenium, perteneciente a la familia Asteraceae.
C. Examinar por cromatografía en capa fina (2.2.27) utilizando una placa de gel de
sílice para CCF R.
Disolución problema. Añadir 20 mL de metanol R a 1 g de droga pulverizada
(355). Calentar en un baño de agua a 60 0c durante 15 min. Dejar enfriar y filtrar.
Evaporar el filtrado hasta sequedad a presión reducida y disolver el residuo en 2 mL
de metanol R.
Disolución de referencia. Disolver 5 mg de partenólido R en metanol R y
completar hasta 5 mL con el mismo disolvente. Aplicar separadamente sobre la
placa, en bandas, 20 µL de cada disolución. Desarrollar hasta una distancia de 10
cm utilizando una mezcla de 15 volúmenes de acetona R y 85 volúmenes de
tolueno R. Dejar secar la placa al aire y a continuación pulverizarla con una
disolución de 5 g/L de vainillina R en una mezcla de 20 volúmenes de etanol R y 80
volúmenes de ácido sulfúrico R. Examinar la placa a la luz visible después de 5

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
13
min. El cromatograma obtenido con la disolución problema presenta en su zona
central una banda principal azul, similar en cuanto a su posición, coloración y
dimensiones a la banda principal del cromatograma obtenido con la disolución de
referencia; una segunda banda azul puede aparecer debajo de la banda principal. El
cromatograma, además, presenta una o dos bandas de color azul en el tercio
inferior. Otras bandas de color violeta pueden también ser observadas.
VALORACIÓN. Examinar por cromatografía de líquidos (2.2.29).
Disolución problema. Tomar aproximadamente 50 g de droga y pulverizarla
completamente (355). Homogeneizar el polvo. Introducir 1,00 g de droga
pulverizada en un matraz de fondo redondo y añadir 40 mL de metanol R. Calentar
en baño de agua a 60 0c durante 10 min. Dejar enfriar y a continuación filtrar. Lavar
el filtro con 15 mL de metanol R. Recoger el residuo con 40 mL de metanol R.
Repetir la extracción. Reunir los filtrados y la disolución de lavado y evaporar hasta
sequedad a presión reducida. Disolver el residuo con metanol R y completar hasta
20,0 mL con el mismo disolvente. Tomar 10,0 mL de esta disolución y completar
hasta 50,0 mL con la fase móvil. Filtrar (0,45 µm).
Disolución de referencia. Disolver 5,0 mg de partenólido R en metanol anhidro R
y completar hasta 10,0 mL con el mismo disolvente. Tomar 2,0 mL de esta
disolución y completar hasta 50,0 mL con la fase móvil. La cromatografía se puede
llevar a cabo utilizando: Una columna de acero inoxidable de 0,25 m de largo y de
4,6 mm de diámetro interno, rellena de gel de sílice octadecilsililado para
cromatografía R (5 µm), como fase móvil, a un caudal de 1 mL/min, una mezcla de
40 volúmenes de acetonitrilo R y de 60 volúmenes de agua R. Como detector, un
espectrofotómetro ajustado a 220 nm. Inyectar 20 µL de cada disolución. El tiempo

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
14
de retención el partenólido es aproximadamente 11,5. Calcular el porcentaje de
partenólido con la ayuda de la siguiente expresión:
A1 = área del pico del compuesto principal en el cromatograma obtenido con la
disolución problema.
A2 = área del pico del compuesto principal en el cromatograma obtenido con la
disolución de referencia.
m1 =masa de muestra utilizada en la disolución problema, en gramos.
m2 =masa de partenólido en la disolución de referencia, en gramos.
CONSERVACIÓN. Protegida de la luz.[27]
I.2.2-Consideraciones generales referentes a técnicas cromatográficas aplicadas al análisis de lactonas sesquiterpénicas. Aunque varios investigadores precedieron a Tsweet en la descripción de métodos
que se pudieran llamar cromatográficos, el descubrimiento de esta técnica analítica
se atribuye corrientemente a este científico ruso, quien observó en 1906 que los
pigmentos de las hojas verdes de las plantas podían separarse al hacer atravesar un
extracto de ellas en una columna rellena con carbonato de calcio.
A partir de estos experimentos iniciales, la técnica cromatográfica se ha
diversificado en un numero de técnicas de separación que incluyen la cromatografía
de papel, la de placa delgada, la de columna, la liquida, la gaseosa y otras.
La cromatografía es una técnica por la cual los componentes en una muestra, corrida
en fase liquida o gaseosa, son resueltos por pasos de sorción y desorción de la fase

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
15
estacionaria. Estos métodos son comúnmente usados para el análisis cualitativo y
cuantitativo de material vegetal, materia prima, productos terminados y compuestos
presentes en fluidos biológicos. Los componentes monitoreados incluyen drogas
quirales o aquirales, impurezas residuos de solventes, excipientes, productos de
degradación y metabolitos. [28]
Los métodos cromatográficos se pueden clasificar en:
Cromatografía liquida de alta precisión.
Cromatografía de gases.
Cromatografía de fluidos supercríticos (capa fina). [28]
Para el análisis de los sesquiterpenos los métodos preferidos son: GC, GC-EI-MS,
GC-CI-MS, GC-MS-MS, GC-FT-IR, GC-UV, GC-AES, C-NMR, PY-GC-MS,
HPLC, HPLC-TSP, SFE, SFC, SFC-UV. El HPLC es el método de elección. [29]
Las técnicas cromatográficas son requeridas para la separación óptima, identificación
y aislamientos de componentes individuales. Dentro del grupo de los sesquiterpenos
sus lactonas presentan un interés especial. [29]
I.2.3-Métodos analíticos aplicados a las estructuras
sesquiterpenoides.
Recientemente Kubeczka propone métodos analíticos aplicados al análisis de aceites
esenciales y pueden ser clasificado en tres grupos diferentes: Cromatografía gaseosa
(GC), cromatografía liquida (HPLC) y cromatografía de fluidos supercríticos (SFC),
incluyendo cromatografía multidimencional acoplada a otras técnicas. [29]

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
16
I.2.4- Cromatografía de Capa Delgada (CCD). I.2.4.1- Separación y análisis cromatográfico de lactonas sesquiterpénicas.
Las sesquiterpenlactonas pueden separarse y analizarse bien sea por cromatografía
en columna o cromatografía en capa fina, utilizando sílica gel y eluyentes como:
Cloroformo: Metanol (9:1), Cloroformo: Metanol (19:1), Cloroformo: Éter etílico
(4:1), Cloroformo: Éter etílico (5:1), Benceno: Acetona (4:1), Benceno: Acetato de
Etilo (5:5), etc. Como agentes visualizadores ó reveladores para los análisis por
Cromatografía en capa fina pueden utilizarse: Ácido sulfúrico concentrado y
calentamiento, vapores de yodo, Luz Ultravioleta 254 nm o Permanganato de potasio
al 1%. También se han reportado otros reveladores para las sesquiterpenlactonas. [6]
Actualmente, se pueden separar y analizar mezclas de sesquiterpenlactonas en poco
tiempo, por cromatografía líquida de alta eficiencia.
Según Domínguez, X. Alejandro la partenina puede ser aislada a partir de un
extracto etanólico realizando una extracción previa con éter de petróleo, la fracción
etanólica se evapora y el residuo es extraído con cloroformo, esta solución en
cromatografía de capa fina ( CCF ) muestra cinco manchas Rf = 0.85 (verde);
Rf = 0.78 (verde brillante); Rf = 0.55 (carmelita); Rf = 0.45 (azul); Rf = 0.18
(amarillo), usando como solvente cloroformo-acetona (9:1) y ácido sulfúrico como
agente cromogénico.
La cromatografía de capa fina es un procedimiento que se utiliza para separar
moléculas relativamente pequeñas. Al igual que otras cromatografías, consiste de
una fase estacionaria y una fase móvil y el principio es el mismo: la sustancia de

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
17
interés se adherirá a la fase estacionaria o se moverá con la fase móvil, viajando una
distancia que es inversamente proporcional a la afinidad por la fase estacionaria. [30].
La localización del analito sobre la placa es descrito por el valor de Rf o factor de
retardo, parámetro cualitativo que puede ser definido como:
Rf = Distancia corrida por la muestraDistancia solvente
A pesar de las variaciones posibles, cuando las condiciones de trabajo no se
controlan adecuadamente, los valores de Rf son los medios más convenientes para
localizar las posiciones de un compuesto en diferentes sistemas de eluyentes. El
valor de Rf puede reproducirse en el mejor de los casos, con dos cifras significativas
aunque al considerar varias placas, una sola cifra significativa, da una idea real de la
precisión. [30].
El Rf depende de muchas variables que deben tenerse en cuenta para obtener
resultados reproducibles; como son:
1. Calidad del adsorbente
2. Grosor de la fase estacionaria
3. Humedad de ambas fases
4. Temperatura
5. Grado de saturación de la cámara con los vapores de la fase móvil
6. Tamaño de la muestra.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
18
Los cromatogramas pueden valorarse semi y/o cuantitativamente ya sea analizando
el tamaño de las manchas (métodos de comparación), por densitometría, o a través
del método de elusión o límite de detección. [30, 31, 32]
El uso combinado de la cromatografía en capa delgada con reactivos de aspersión
puede proveer buenos resultados. El ácido fosfórico-vainillina, anisaldehído o p-
dimetilaminobenzaldehído-ácido sulfúrico, ácido sulfúrico, ácido sulfúrico-
resorcina, cloruro de aluminio o hidroxilamina. Los sesquiterpenoides carentes de un
grupo metileno exocíclico pueden ser visualizados con dimetilamina seguida por el
reactivo de Dragendorff. La selección de reactivo de revelado depende de la
estructura del esqueleto carbonado. La cromatografía puede ser usada para separar
diastereoisόmeros, tales como partenina e himenina mediante el desarrollo múltiple
de placas con el mismo sistema de solventes. [29]
I.2.5- Reactivos de comprobación empleados en Cromatografía de
Capa Delgada (CCD).
Muchos compuestos no manifiestan color propio por lo que no son visibles en el
cromatogramas. Hay que hacerse visibles con reactivos de comprobación especiales,
que en general, se aplican con un pulverizador o atomizador. La aspersión no debe
ser excesiva con objeto de que las manchas de las sustancias no difundan. En
muchos casos los productos de reacción fluorecen, absorben bajo luz UV o forman
un compuesto coloreado que hace visible la mancha. Numerosos compuestos
orgánicos se hace visibles por acción del vapor de yodo o aspersión con solución de
yodo, de ahí que sea conocido como revelador universal. El yodo en la mayoría de
los casos, solamente se une físicamente y se pueden emplear por esto como reactivo
de comprobación antes de las determinaciones cuantitativas, siendo muy usado pero
poco especifico. [31]

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
19
Para la determinación de lactonas se reportan otros reactivos de comprobación,
específicos, que pueden ser usados, como son: Solución de permanganato de potasio
al 5 % en agua, p-dimetilaminobenzaldehido, vainillina, p-dimetilisatina 0.4 % en
ácido sulfúrico. Los reactivos de vainillina y p-dimetilaminobenzaldehido se
preparan antes del uso, en proporciones de: 0,5g del reactivo, 9 mL de etanol, 0,5ml
de ácido sulfúrico concentrado y tres gotas de ácido acético glacial. La identificación
se produce por la ocurrencia de una reacción de coloración con el componente
evaluado, reportándose para la partenina la formación de un color azul-violeta frente
a la vainillina y Amarillo-oro frente a p-dimetilaminobenzaldehido, siendo la fase
móvil cloroformo-acetona (6:1). La muestra se disuelve en acetona o cloroformo y
se puntea de 5 a 10 µg de cada componente, después de desarrollado el
cromatograma, las placas secadas se atomizan con la solución reveladora y se
colocan al calor a una temperatura de hasta 70˚c. [33]
La mínima cantidad detectable de partenina en µg para los diferentes reactivos, se
refiere en la tabla 1. [33]
Tabla 1: Mínima cantidad detectable de partenina en µg para los diferentes reactivos.
Vapores de yodo (µg)
KMnO4 5% en agua (µg) Vainillina (µg) p-dimetilamino
Benzaldehído (µg)
1.0 0.5 0.5 0.05
I.2.6- Cromatografía Liquida de Alta Eficacia. (HPLC). La cromatografía es un método de separación el cual depende para su eficiencia de
la distribución de equilibrio de las moléculas de soluto entre dos fases, una

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
20
estacionaria sobre la cual fluye la segunda, aquellos solutos distribuidos
preferentemente en la fase móvil podrían pasar rápidamente a través del sistema.
La fase estacionaria esta contenida en un tubo apropiado llamado columna, puede
ser un sólido, un líquido soportado sobre un sólido o un gel y la fase móvil es
bombeada (o en ocasiones fluye bajo gravedad) a través de la columna. La muestra
es colocada en la punta de la columna usando un apropiado sistema de
introducción de muestra y después de pasar a través de la columna los componentes
separados son detectados usando un detector apropiado cuya salida se muestra en
un registrador.
Esencialmente consiste en hacer pasar la fase móvil líquida constituida por un
disolvente adecuado, en el que esta disuelta la muestra, a una presión muy elevada, a
través de una columna que contiene la fase estacionaria. Por su distinta interacción
con las dos fases, las muestras son retenidas con mayor o menor intensidad,
eluyendo separadas de la columna. Se puede recoger el eluyente de la columna para
un análisis posterior o analizar directamente el eluyente por medio de un detector
situado a la salida, que mide la variación de una determinada propiedad física del
líquido (absorbancia, índice de refracción, etc.), permitiendo el registro de una serie
de picos, correspondientes a las distintas fracciones que eluyen de la columna.
Además se puede conocer la concentración de cada componente a partir de la altura
o el área de los picos. [30, 34, 35]
La cromatografía líquida se puede clasificar basándose en la naturaleza de la fase
estacionaria y en los procesos de separación en: Cromatografía de absorción,
Cromatografía de partición, Cromatografía de intercambio iónico, Cromatografía de
exclusión. [27, 30, 35, 36]

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
21
El análisis por el HPLC ofrece ventajas en comparación con la cromatografía
gaseosa. El HPLC puede ser empleado para el análisis de compuestos termolábiles
y polares, el acoplamiento con detector (arreglo de diodos) puede ser útil. Muchos
sesquiterpenoides volátiles carentes de grupos cromofόricos no pueden ser
analizados por HPLC con detección UV a 254 nm. Es estos casos el índice de
refracción ó el monitoreo a bajas longitudes de onda es necesario. A menudo esta
última variante es preferida debido a que la detección o índice de refracción no es
sensible a bajas concentraciones. [29]
En el año 2000 Saucedo llevo a cabo la determinación cuantitativa de partenina en
extracto de hojas de Parthenium hysterophorus Linn, mediante Cromatografía
Líquida de alta eficacia. (HPLC). En este caso el método usado se basa en la
separación de la partenina del resto de los componentes del extracto a través de una
columna para HPLC, rellena con fase estacionaria LiChrospher- 100 RP- 18, fase
móvil acetonitrilo - agua en mezcla (50: 50) , flujo de 0,3 mL/ min y su detección
para la cuantificación mediante detector diode array. Como resultado se obtuvo que
la técnica resultó lineal, precisa, exacta, sensible y específica, bajo las condiciones
de trabajo establecidas. [37]
I.2.7- CLAE con detección UV. Los sesquiterpenoides son compuestos de baja volatilidad y muchos de ellos son
termolábiles. Debido a estas propiedades, el HPLC principalmente en fase reversa
es el método analítico de elección para el análisis de sesquiterpenlactonas en
extractos crudos de plantas. Sin embargo, la corrida en gradiente (fase normal) con
n-hexano-acetonitrilo-isopropanol, desde hace algún tiempo es preferida. El HPLC
ha sido aplicado satisfactoriamente para el análisis de 33 pseudogiuanόlidos y
xantanόlidos del género Parthenium. Gradientes de agua-acetonitrilo o agua-
metanol son usados respectivamente. Las condiciones cromatográficas empleadas

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
22
para las especies de de Parthenium son: ultraesphere-ODS (15 x 4,6), fase móvil:
agua-acetonitrilo y detección a 215 nm. Otra variante seria emplear: columna de
nucleosil c (5μm, 25 x 4 mm); fase móvil: metanol-agua; detección a 210 nm. [29]
I.3- Validación de técnicas de análisis. La realización del proceso de validación tiene gran importancia ya que proporciona
un alto grado de confianza y seguridad en el método analítico y en la calidad de los
resultados, disminuyendo así el número de fallas y repeticiones, con el consiguiente
orden de los costos asociados. [35, 36]
La validación, no es más que la obtención de pruebas convenientemente
documentadas demostrativas de que un método de fabricación o control es lo
suficientemente fiable como para producir el resultado previsto dentro de intervalos
definidos. Esta es necesaria pues proporciona un alto grado de confianza y seguridad
en el método analítico y en la calidad de los resultados, permite un conocimiento
profundo y caracterizar su funcionamiento. [7, 38]
Los estudios de validación difieren notablemente según el tipo de método analítico,
se puede observar que no siempre se estudian los cinco criterios de validación
fundamentales: linealidad, precisión, exactitud, sensibilidad y especificidad, siendo
estos parámetros claves en la validación cuantitativa de un componente o principio
activo. [38]
I.3.1-Linealidad. Se define como linealidad la capacidad de un método analítico de obtener resultados
linealmente proporcionales a la concentración del analito en la muestra dentro de un
intervalo determinado, puede efectuarse tanto sobre muestras problemas como

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
23
soluciones patrón que contengan concentraciones crecientes de analito efectuándose
posteriormente en tratamiento matemático de los resultados.[28, 38]
En primer lugar, conviene cerciorarse de que el intervalo lineal dinámico del sistema
instrumental es más amplio que el intervalo de concentraciones a estudiar,
seguidamente se debe preparar una serie de patrones de analito de concentraciones
crecientes. El número de soluciones patrón puede estar comprendido entre 3-10, y el
intervalo de concentración se selecciona de acuerdo con las cantidades esperadas de
analito de la muestra.
Valoración de una materia prima: se analiza de 3-5 soluciones patrón a un
intervalo de concentración de 80-120 % de la teórica.
Valoración de un principio activo en un producto acabado: se analiza de 5-7
soluciones patrón con un intervalo de concentración de 50-150 % de la teórica.
Se efectúa el análisis siguiendo exactamente en procedimiento descrito, al menos por
duplicado y se determina la curva de calibración que relaciona respuesta con
concentración o cantidad de analito.
La ecuación de la recta es la siguiente:
y = bx + a Donde:
y: respuesta
b: valor de la pendiente
x: concentración
a: término independiente

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
24
Finalmente se realiza el tratamiento estadístico de los datos para evaluar la linealidad
y la proporcionalidad mediante los siguientes parámetros:
Coeficiente de correlación (r): refleja el grado de correlación entre las variables
x (concentración) e Y (respuesta). Su valor máximo es 1, si r es cercano a la unidad
significa que existe correlación con una probabilidad elevada. En análisis químico se
obtienen valores de r iguales o superiores a 0.999. [28, 38]
Fórmula para hallar r:
⎥⎥⎦
⎤
⎢⎢⎣
⎡−∗
⎥⎥⎦
⎤
⎢⎢⎣
⎡−
∗−
=−∗−
−∗−=
∑ ∑∑ ∑∑ ∑ ∑
∑ ∑∑
nY
YnX
X
nYX
XY
YYXX
YYXXr
)()()()(
)()(2
22
222
Coeficiente de variación de los factores respuesta (CVf): Es la relación entre la
lectura y la concentración. Para una concentración determinada, el factor de
respuesta puede tomarse como una expresión aproximada de la sensibilidad de
calibrado a esta concentración. En una correlación lineal los factores de respuesta
deben ser semejantes y cercanos al valor de la pendiente, por este motivo puede
tomarse el coeficiente de variación de los factores de respuesta como una expresión
de la linealidad. Un coeficiente de variación superior al 5 % indican falta de
linealidad. [28, 38]
100∗=f
SCVf f
UDonde:
f – Factor de respuesta. XYfi =
⎯f - Media de f. n
ff ∑=

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
25
Sf - Desviación Standard de 1
)( 21
−
−= ∑
nff
f
Cvf – Coeficiente de variación de los factores respuesta. n: número de factores respuesta.
Desviación Standard relativa de la pendiente (Sbrel): que es usado como
expresión matemática de la linealidad. Valores superiores al 2 % indican falta de
linealidad. [28, 38]
100(%) ∗=bSbSbrel
2SbSb =
∑ ∑∑ −
=−
nX
Xxx
Sb SS yxxy2
2
2
,2
2
,2
)()(
[ ]
)1(2
)(22
)()()(
)(
,2
222
2
2
2 rn
YYn
XYbYaYn
XXYYXX
YX
xys −−
−=
−
−−=
−
−
−∗−−−
∑∑ ∑ ∑∑ ∑∑
=
Donde:
Sb: desviación estándar de la pendiente.
S2: varianza de la pendiente.
S2y,x : varianza del error experimental total.
n: numero de determinaciones (n = N. K ).
r2: número de series o puntos.
N: número de réplicas o curvas.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
26
Límites de confianza del término pendiente.
Los límites de confianza de la pendiente se hallan a partir de la expresión :
b ± t . Sb siendo t valor de la distribución de student para n – 2 grados de libertad y a
la probabilidad escogida, generalmente p = 0.05.
Otro test estadístico de b se deduce de la expresión:
Sbb
t =exp
En la tabla de t se halla el grado de significación para n-2 grados de libertad. Interpretación de los resultados:
Si texp > ttab se cumple la hipótesis alternativa b ≠ 0
Si texp < ttab significa que la recta es paralela al eje de las abscisa y no habría regresión.
UTest de proporcionalidad. El valor de la pendiente (a), indica el error sistemático del método. Estos límites
deben incluir al cero para que se cumpla la condición de proporcionalidad. [38]
S ata ∗± 2SaSa = 100∗=
aSaSarel
nX
XXnX
nnX
XnX
SbSa SS xyxy ∑∑
∑∑ ∑
∑ ∗−
=∗∗∗
=∗=2
2
2
,2
22
2
,2
22
)()(
Donde:
t – Valor de la distribución de student para n-2 grado de libertad.
n – Número de determinaciones.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
27
Sa2 – Varianza del término independiente.
Sa – Desviación Standard del termino independiente.
Sa rel. – Desviación Standard relativa del termino independiente.
I.3.2- Precisión. Es el grado de concordancia entre los valores de una serie repetida de ensayos
analíticos efectuados sobre una muestra homogénea o expresado de otra forma, la
distribución de los valores analíticos alrededor de su media. Indica el grado de
reproducibilidad del método bajo condiciones normales de trabajo, es decir, la
capacidad del método para dar resultados semejantes cuando se aplica repetidamente
a una muestra. Dentro del término precisión se pueden distinguir tres tipos de
estudio: [28, 38]
Repetibilidad: es la medida de la precisión de un método efectuado en las
mismas c²ondiciones, sobre la misma muestra, por un mismo analista, en el
mismo laboratorio, con los mismos equipos, reactivos y en el curso de la misma
serie de análisis efectuados generalmente en un corto intervalo de tiempo. El
número de repeticiones deberá ser igual o mayor que 5 y la concentración de
analito en la muestra problema similar a la nominal o declarada.
La repetibilidad se expresa matemáticamente por la desviación estándar o
preferiblemente por el coeficiente de variación. El valor aceptado de precisión de
un método depende de la concentración del analito en la muestra y del número de
repeticiones del análisis. [38]

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
28
100*−=X
SCV
nXi
X ∑=−
2
)(n
XXiS ∑
−
−=
Donde:
CV: Coeficiente de variación.
S: Desviación estándar de la concentración.
x−
: Media de los valores de la concentración.
n: Número de valores de la concentración.
Precisión intermedia: es la medida de la precisión de los resultados de un
método analítico sobre la misma muestra y en condiciones diferentes (analistas,
equipos, días). El coeficiente de variación (%) de la precisión intermedia debe ser
inferior al doble de repetibilidad. El cálculo es idéntico al estudio de repetibilidad
solo que aquí intervienen un número mayor de valores de concentración. [38]
Robustez: evalúa los efectos de pequeños cambios en las condiciones
operacionales del análisis sobre la fidelidad del método analítico. Es el grado de
reproducibilidad de un método analítico sometido deliberadamente a pequeñas
variaciones en el modo de operación con el objeto de conocer su estabilidad frente
a ellas y definir las de mayor influencia sobre la variabilidad de los resultados. [38]

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
29
I.3.3- Exactitud. Indica la capacidad del método analítico para dar resultados lo más próximo
posibles al valor verdadero. Si la diferencia entre el valor hallado y el verdadero
es pequeña la exactitud es buena. Una diferencia grande significa que la exactitud
es inadecuada y revela la existencia de errores determinantes que debieran
corregirse. [28, 38]
No deben confundirse exactitud y precisión. La precisión esta relacionada con la
dispersión de una serie de mediciones, pero no da ninguna indicación de lo cerca
que están del valor verdadero. Podemos tener mediciones muy precisas pero poco
exactas; sin embargo, para que un método sea exacto se requiere un cierto grado
de precisión. [38]
Matemáticamente la exactitud se expresa en forma de porciento de recuperación
de la cantidad de analito presente en la muestra, o bien en forma de diferencia
entre el valor hallado y el valor verdadero.
Estadísticamente suele efectuarse un test de t para determinar si el valor medio
hallado y el valor considerado verdadero no difieren significativamente para un
grado de probabilidad determinado. [38]
S
nm
nS
m
x
m xxs
xt
−−−
−=
−=
−=
−exp

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
30
Donde:
m: valor verdadero.
: valor medio. x−
n: número de determinaciones.
S: desviación estándar.
n
SxS =− : desviación de la media.
Interpretación:
Si texp < ttab
para el riesgo escogido (p 0.05) y n-1 grados de libertad,
significa que ambos valores no son estadísticamente diferentes y que el
método analítico tiene la exactitud requerida.
Sitexp < ttab
significa que el método no es exacto y que existe un error
sistemático, por defecto o exceso, que en valor absoluto es: xm−
−
La determinación de la exactitud puede realizarse por:
a) Análisis repetitivo de una muestra de concentración única conocida: la
muestra generalmente será un placebo al que se añade una concentración de
analito patrón. Se analiza varias veces procesándose los resultados
estadísticamente.
b) Análisis repetitivo de varias muestras de concentraciones diferentes
conocidas: se evalúa este parámetro, para diferentes concentraciones, si la
proporción de analito en la muestra varía notablemente o si se requiere un
estudio riguroso.

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
31
c) Método de adición de estándar: es de mucha utilidad cuando no se dispone de
un placebo o muestra de concentración conocida. Para ello se dispone de una
muestra de la que se toman varias alícuotas. Se añaden posteriormente
concentraciones crecientes y conocidas de analito a estas alícuotas. Las
soluciones de ensayo son analizadas y de los resultados se puede obtener una
curva de calibración. Se grafica cantidad recuperada contra cantidad añadida,
siendo la pendiente de la recta obtenida la recuperación del método.
d) Comparación con otro método analítico: se parte de una muestra homogénea
que se analiza repetidamente (n≥6) por el método analítico nuevo y por el de
referencia. Los resultados se procesan estadísticamente. [38]
I.3.4- Especificidad. La especificidad o selectividad es la capacidad de un método analítico para medir
exacta y específicamente el analito sin interferencias de impurezas, productos de
degradación, compuestos relacionados o excipientes que pueden estar presentes
en la matriz de la muestra. La especificidad de un método analítico se determina
comparando los resultados del análisis de muestras que contienen impurezas,
productos de degradación, sustancias relacionadas o excipientes con el resultado
del análisis de muestras que no contiene dichas sustancias. [28, 38]
I.3.5- Sensibilidad. Parámetro que se relaciona con la cantidad de analito requerida para dar un
resultado significativo, cualitativo o cuantitativo. La sensibilidad es la capacidad
de un método analítico de registrar ligeras variaciones en las concentraciones.
Incluye el límite de detección que es la menor concentración o cantidad de analito

Capítulo I. Revisión Bibliográfica
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
32
detectable con razonable certeza por un procedimiento analítico dado, o sea, la
cantidad o concentración mínima de analito a partir de la cual es factible realizar
el análisis; y el límite de cuantificación que es la menor concentración o cantidad
de analito de una muestra que puede ser determinada con aceptable precisión y
exactitud bajo las condiciones experimentales establecidas. [28, 38, 39]
I.4- Métodos espectroscópicos empleados en la elucidación estructural. La espectrofotometría UV-Vis tiene una aplicación algo limitada para el análisis
cualitativo, ya que el número de máximos y mínimos de absorción es
relativamente pequeño por tanto una identificación inequívoca es a menudo
imposible. Sin embargo, es útil para detectar la presencia de ciertos grupos
funcionales que actúan como cromóforos. Las posiciones de los máximos de
absorción se ven afectadas por la naturaleza del solvente.
Debido a la gran variedad de esqueletos carbonados no es posible dar
características espectrales de un único esquema; sin embargo, algunos valores
pueden ser característicos como la absorción UV entre 205 – 212 nm ( ε 14000 –
5000 ) y la señal al 1750 cm -1 en IF para el anillo de γ–lactona –α,β-insaturada; la
aparición en el RMN -1 H de los dobletes generalmente uno por debajo de 6.0
PPM y otro por encima con J = 1.0– 4.0 Hz para los dos protones α–metileno del
C – 13; y con acoplamientos geminales de 0.7 – 0.2 Hz. En el espectro RMN -13 C
es típico el valor aproximado a 170 PPM debido al carbono lactónico. [30, 40]

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
33
Capítulo II. Materiales y Métodos
La presente investigación se realiza en el Departamento de Farmacia de la Facultad de
Química y Farmacia, durante la etapa comprendida desde Febrero hasta Junio de 2006.
Se utilizan las partes aéreas de la planta procedente del área correspondiente al Reparto
Universitario.
Se emplea en todos los procedimientos desarrollados, cristalería específica de laboratorio,
previamente descontaminada, así como reactivos de calidad analítica y equipos
certificados como aptos para el uso.
II.1.- Recolección, secado y molinado del material vegetal.
El material vegetal objeto de estudio (Parthenium hysterophorus, L.), con vistas al
desarrollo de esta experiencia fitoquímica y analítica fue recolectado de un entorno
natural localizado, en las áreas correspondientes al Reparto Universitario de Santa Clara,
de suelo predominante pardo con carbonatos, entre los meses de Septiembre de 2005 y
Diciembre de 2005.
El secado de la planta se efectúa en estufa MLW WLU – 100 a una temperatura de de 40
± 1 0C en bandejas esmaltadas, durante un período de 72 horas, hasta una pérdida de peso
constante de acuerdo a los resultados obtenidos por otros autores (Galbán M., 1997).
La planta seca se tritura hasta obtener un sólido pulverulento con un tamaño de partícula
(0,215 mm) ≤ 0,3 mm (León I., 1999), con el empleo de un molino de cuchillas regulable
tipo Restsch Gmbh 5657 tipo SR.2.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
34
II.2- Metodología de extracción del componente de interés (partenina).
Según lo reportado en la literatura (Nogueiras C., 1996; Placencia V., 1998) sobre la
técnica de extracción más adecuada para la obtención de partenina como principio activo,
se desarrolla la siguiente metodología:
Se toman 40,0 g de material vegetal molinado y se realiza una maceración con 250 mL de
metanol durante 24 horas. El extracto obtenido es concentrado hasta la mitad del volumen
original y se añade igual cantidad de agua destilada, el residuo sólido que se forma, se
filtra y la solución resultante es extraída sucesivamente tres veces con 60 mL de
cloroformo. La fracción clorofórmica se rotoevapora hasta la obtención de un aceite de
color amarillento.
Esta fracción concentrada se puntea en cromatofolios de sílica gel 60 de dimensiones (20
x 20 cm), fase móvil cloroformo-acetona (6:2), (Nogueiras C., 1996; Pickman A. K.,
1980) para corroborar la presencia de la partenina y determinar si las impurezas se
encuentran en bajas concentraciones. La comparación se realiza a partir de la
determinación de la razón de flujo (Rf) bajo las mismas condiciones cromatográficas, del
producto aislado en investigaciones previas, correspondiente a partenina, según
caracterización estructural realizada.
II.3-Aislamiento y caracterización estructural preliminar del
componente de interés terapéutico (partenina) con vistas a su
utilización como patrón analítico. Materiales, utensilios e instrumentos de medición:
1. Cloroformo, panreac. España.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
35
2. Acetona, Analar BDH. Reino Unido.
3. Metanol, Scharlau. España.
4. Etanol, Scharlau. España.
5. n-Hexano, Merck. Alemania.
6. Éter etílico, Merck. Alemania.
7. Acetonitrilo para HPLC, Scharlau. España
8. Agua desionizada
9. Vainillina, Merck. Alemania.
10. Ácido Acético glacial, panreac. España.
11. Acido Sulfúrico (conc), Analar BDH. Reino Unido.
12. Cromatofolios Al de sílica gel 60, Fluka. Alemania.
13. Sólidos pulverulentos de Parthenium hysterophorus, Linn. (tp= 0,215 mm).
14. Patrón de análisis aislado (partenina) (Según metodología referida en el
epígrafe II.2. Se adjunta la caracterización estructural en los anexos: I-IV)
15. Microjeringuilla de 20 µL Hamilton. Estados Unidos.
16. Cámara para cromatografía (25 x 10cm)
17. Balanza analítica digital BOECO, error 0.1 mg, LSP 210 g. Alemania.
18. Cromatofolios Al de sílica gel 60, Fluka. Alemania.
19. Microjeringuilla de 20 µL Hamilton. Estados Unidos.
20. Cámara para cromatografía (25 x 10cm)
21. Cristalería de laboratorio.
22. Plancha de calentamiento.
23. Columna cromatográfica para 100 mL.
24. Baño ultrasónico BRANSON 1510. México.
25. Spectrophotometer UV/Vis, GENESIS 10 µV. Estados Unidos.
26. Lámpara UV, CAMAG
27. Rotoevaporador BÜCHI R-200. Alemania.
28. CLAE Agilent 1100 series
29. Microplatina digital, Electrothermal 9200. Reino Unido.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
36
El Parthenium hysterophorus, L. (escoba amarga) posee como constituyentes químicos
principales, responsables de sus diversas acciones farmacológicas, a las lactonas
sesquiterpénicas. La partenina, dentro de este grupo estructural sesquiterpenoide, no es
comercializada, por lo que resulta indispensable su aislamiento, con vistas a su posible
utilización como patrón analítico, lo cual posibilita su cuantificación en el sólido
pulverulento obtenido a partir de la planta.
Para el aislamiento de partenina se parte del desarrollo de la metodología extractiva del
componente a partir del sólido pulverulento, citada anteriormente en el epígrafe II.2.
El extracto clorofórmico concentrado obtenido se hace pasar por una columna
cromatográfica de dimensiones (50 x 2,5 cm) rellena con fase estacionaria de Sílica Gel y
se eluye el mismo con la fase móvil diclorometano-metanol (75:25). Se colectan 15
fracciones de 3 mL cada una, las que posteriormente se separan por cromatografía en
Capa Delgada (CCD), con el objetivo de lograr la separación de la partenina del resto de
los componentes que se encuentran en el extracto original.
En los cromatofolios se aplican 20 μL de cada fracción eluida de la columna, junto a las
del extracto clorofórmico concentrado originalmente y del patrón aislado, y se desarrolla
el cromatograma a temperatura ambiente, en una cámara cromatográfica saturada.
Posteriormente, las placas se revelan con luz ultravioleta a una λ= 254 nm y
posteriormente con una solución de vainillina en etanol (0,5g de vainillina, 9 mL de
etanol, 0,5 mL de H2SO4 (c) y 3 gotas de ácido acético glacial), con calentamiento a una
temperatura de 70 0C. La identificación del analito de interés se efectúa en comparación
con el producto aislado en investigaciones previas, bajo similares condiciones
cromatográficas, determinando los valores de Rf de las manchas obtenidas. El revelador
de vainillina empleado logra una coloración específica para la partenina, debido a la
formación del complejo coloreado catalizado por el ácido.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
37
Las fracciones colectadas se reúnen atendiendo al seguimiento cromatográfico en capa
delgada descrito con anterioridad y los resultados de Rf obtenidos en comparación con el
patrón, bajo las mismas condiciones cromatográficas. Las fracciones de la 3 a la 11,
correspondientes a un volumen de 3 mL, se someten a la cristalización del producto,
evaporando el solvente hasta obtener un aceite, luego se disuelve dicho concentrado en
una mínima cantidad de etanol (1mL) y se añade éter-hexano en proporción (1:4) con
posterior refrigeración durante 24 horas.
El sólido obtenido se recristaliza con una mínima cantidad de acetona y posteriormente
se añade hexano gota a gota hasta turbidez lechosa, luego se deja reposar y se decanta
hasta obtener un producto cromatográficamente puro, el cual se analiza
cromatográficamente en capa delgada, (Domínguez X.A., 1970)
Preparación de la porción de ensayo.
Se pesan con exactitud 5,000 mg del producto obtenido y se completa el volumen en
matraz aforado de 2 mL con metanol. Se puntea por triplicado 20 µL de la sustancia
ensayada en el cromatofolio.
La mancha correspondiente a la partenina debe ser visualizada de color violeta
característico, atendiendo a la especificidad que logra el revelador químico con el
compuesto de interés de naturaleza insaturada, en comparación con otros reactivos
cromogénicos (Pickman A. K., Ravieri R., 1980; Pickman A., 1985). Antes de asperjar la
solución se debe colocar la placa a una temperatura de hasta 70 0C.
Se determina la temperatura de fusión del producto que debe ser de 163 - 166˚C.
(Domínguez, X. A., 1970).

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
38
Se realiza la caracterización estructural preliminar del sólido obtenido mediante
Resonancia Magnética Nuclear (RMN) H1+ y C13.
II.4- Desarrollo y validación de técnicas analíticas.
II.4.1- Determinación cuantitativa de partenina en sólidos pulverulentos de Parthenium hysterophorus, L. mediante Cromatografía Líquida de Alta Eficacia (CLAE). Fundamento del método.
El método se basa en la separación de la partenina del resto de los componentes del
extracto a través de una columna para CLAE, rellena con fase estacionaria LiChrospher-
100 RP- 18, fase móvil acetonitrilo - agua en proporción (40: 60), flujo de 1 mL/ min y su
detección a una λ= 210 nm para la cuantificación mediante detector de longitud de onda
variable.
Materiales, utensilios y equipos de medición.
Acetonitrilo para CLAE, Scharlau. España.
Metanol, Scharlau. España.
Agua desionizada y destilada.
Filtro miliporo de 0,45 µm, RC. Agilent Technologies.
Microjeringuilla de 20 µL Hamilton. Estados Unidos.
Cristalería de laboratorio.
Balanza analítica digital BOECO, error 0.1 mg, LSP 210 g. Alemania.
CLAE Agilent 1100 series
Baño ultrasónico BRANSON 1510. México.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
39
Preparación de la solución patrón de partenina. (2,5 mg/mL).
Se pesan con exactitud 5,000 mg, se introducen en un matraz aforado de 2 mL y se
adiciona metanol hasta completar volumen, obteniéndose una solución de concentración
de 2,5 mg/ mL.
Preparación de la solución patrón de partenina. (0,15 mg/mL).(150 mg/ L)
Se toma una alícuota de 120 µL de la solución patrón de partenina 2,5mg/mL, se lleva a
un matraz aforado de 2 mL y se completa el volumen con acetonitrilo-agua (40:60).
Preparación de la muestra.
Se pesan con exactitud 0,5 g de material vegetal y se realiza una extracción con 40 mL de
metanol, agitando en baño ultrasónico durante 10 minutos. El extracto es filtrado y
lavado con 15 mL de metanol. Luego se repite dicha extracción partiendo de los 0,5 g de
material vegetal, y se reúnen los filtrados concentrándolos a vacío en rotoevaporador y
redisolviéndolos en 20 mL de metanol. La disolución es filtrada por miliporo de 0,45 µm
y se inyecta en el instrumento 20 µL de esta solución.
Procedimiento.
Se realiza la inyección de las muestras en el instrumento bajo las siguientes condiciones
cromatográficas:
Fase estacionaria: LiChrospher - 100 RP- 18.
Fase móvil: acetonitrilo - agua (40:60).
Flujo: 1,0 mL/ min
Detector: Longitud de onda variable; λ=210 nm.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
40
Expresión de los resultados.
La expresión de cálculo empleada para la cuantificación es la siguiente:
A pC p
=A mC m
Ap: Área bajo la curva del patrón.
Am : Área bajo la curva de la muestra.
Cm : Concentración de la muestra. (mg/ L)
Cp : Concentración del patrón. (mg/ L)
La concentración de partenina en el material vegetal, se determinó a partir de la curva de
calibración expresada en mg/ L, efectuándose la conversión a las unidades de mg/ mL
para calcular el porcentaje del componente principal. La deducción de la expresión para
el cálculo del por ciento de partenina en base seca se realizó teniendo en consideración
este criterio.
La expresión de cálculo deducida para determinar el por ciento de partenina en el
material vegetal mediante la técnica por CLAE es la siguiente:
apmm
m
b 40100% =⋅=
pérdidaap
%10010040%
−⋅=

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
41
Donde:
p : por ciento (%) de partenina en base seca.
mb : masa buscada de partenina (mg).
mm : masa del material vegetal correspondiente a 500 mg.
a : concentración en mg/ mL obtenida de la recta de calibración.
% pérdida = 10 %.
II.4.2- Validación de la técnica analítica de Cromatografía Líquida de Alta Eficacia (CLAE) para la cuantificación de partenina en el extracto vegetal.
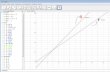
II.4.2.1- Linealidad.
Preparación de la solución patrón (2,5 mg/mL).
Se pesan con exactitud 5,000 mg, se introducen en un matraz aforado de 2 mL y se
adiciona metanol hasta completar volumen.
Preparación de las soluciones de ensayo.
Se prepara cinco patrones de concentraciones crecientes conocidas a partir de la solución
inicial de concentración 2,5 mg/mL, estas son las siguientes: 0,05 mg/mL (50mg/ L), 0,10
mg/mL (100 mg/ L), 0,15 mg/mL (150 mg/ L), 0,20 mg/mL (200 mg/ L), 0,25 mg/mL
(250 mg/ L).

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
42
Se toman con exactitud de la solución de concentración 2,5 mg/mL, los siguientes
volúmenes: 40 μL, 80 μL, 120 μL, 160 μL, 200 μL, se colocan en matraces aforados de
2 mL, y se completa el volumen con acetonitrilo-agua (40:60).
Las condiciones cromatográficas coinciden con las señaladas en el epígrafe II.4.1
(Determinación cuantitativa de partenina en sólidos pulverulentos de Parthenium
hysterophorus, L. mediante Cromatografía Líquida de Alta Eficacia. (CLAE).
Procedimiento.
Se realizan tres curvas de cinco puntos, con tres réplicas para cada valor de
concentración. Estos datos se procesan mediante el tabulador electrónico EXCEL, para
obtener los resultados de la pendiente (b), el término independiente (a) y el coeficiente de
correlación (r ). El coeficiente de variación de los factores respuesta (CVf), la desviación
estándar relativa de la pendiente (Sb rel) y los límites de confianza del término
independiente se obtienen a través de las fórmulas descritas en el epígrafe (I.3).
II.4.2.2- Precisión.
Materiales, utensilios y equipos de medición:
Acetonitrilo para CLAE, Scharlau. España.
Metanol, Scharlau. España.
Agua desionizada y destilada.
Filtro miliporo de 0,45 µm, RC. Agilent Technologies.
Microjeringuilla de 20 µL Hamilton. Estados Unidos.
Cristalería de laboratorio.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
43
Balanza analítica digital BOECO, error 0.1 mg, LSP 210 g. Alemania.
CLAE Agilent 1100 series
Baño ultrasónico BRANSON 1510. México.
a) Repetibilidad.
Se emplean seis muestras, desarrollándose dos réplicas para cada una, preparadas y
analizadas por el mismo analista, el mismo día y bajo las mismas condiciones de trabajo.
Se halla la desviación estándar (s) y el coeficiente de variación (CV).
Preparación de la muestra.
Se pesa 0,5 g de material vegetal y se adicionan 40 mL de metanol, se agita en baño
ultrasónico durante 10 minutos, luego se filtra y se lava con 15 mL de metanol, dicha
extracción se repite y finalmente reúnen los filtrados, concentrándolos a vacío y
redisolviéndolos en 20 mL de metanol. Seguidamente se filtra la suspensión por miliporo
de 0,45 µm y se inyecta en el instrumento 20 µL de esta solución.
Procedimiento.
Se inyectan al instrumento 20 μL de cada solución, por duplicado.
Expresión de los resultados.
Los resultados se expresan según lo reportado en el desarrollo de la técnica, en el epígrafe
II.4.1, teniendo en cuenta lo referente a la preparación de la muestra.
Se halla la desviación estándar (S) y el coeficiente de variación (CV). [epígrafe I.3.2].

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
44
a) Precisión Intermedia.
Se emplean seis muestras, desarrollándose dos réplicas para cada una, preparadas y
analizadas por un analista, en tres días diferentes.
Se realiza mediante un procedimiento estadístico, un análisis de varianza para comparar
la F- fischer calculada y crítica junto a la determinación del índice de Cochran.
II.4.2.3- Exactitud.
Para la evaluación de este parámetro se emplea el método de adición de estándar. Los
materiales, utensilios e instrumentos de medición coinciden con lo reportado para el
ensayo de repetibilidad.
Preparación de las soluciones de muestras a ensayar.
Se preparan tres muestras a analizar, cada una contiene una concentración conocida
adicional de solución patrón de partenina en un orden creciente.
Preparación de las soluciones estándar.
El procedimiento para la preparación de las soluciones de ensayo coincide con lo
reportado para la comprobación de la linealidad de la técnica.

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
45
Procedimiento.
Se pesan tres veces, separadamente, 0,5 g de material vegetal se colocan en erlenmeyer
diferentes y se les añaden 0,1; 0,2; 0,3 mL de solución patrón 2,5 mg/mL,
correspondiente a las concentraciones de 0,05; 0,075; 0,1mg/mL (50, 75, 100mg/ L),
respectivamente. Luego se procede igual que para la preparación de las muestras en el
ensayo de precisión. Se realizan tres réplicas para cada concentración.
Expresión de los resultados.
Los resultados de concentración de partenina se calculan basándose en la interpolación de
la curva de calibración. Estos son graficados contra la cantidad de patrón añadida
obteniéndose una recta cuya pendiente multiplicada por 100 expresa el % de recobrado.
II.4.2.4- Especificidad. Se realiza un estudio comparativo de los cromatogramas obtenidos para la partenina
patrón y para el extracto vegetal que contiene dicha lactona, bajo las mismas condiciones
cromatográficas.
Se lleva a cabo la determinación de los intervalos de confianza de los factores de simetría
para los picos de muestra y patrón.
II.4.2.5- Sensibilidad.
Se realiza la determinación del límite de detección que es la menor concentración o
cantidad de analito detectable con razonable certeza por un procedimiento analítico dado,
o sea, la cantidad o concentración mínima de analito a partir de la cual es factible realizar

Capítulo II. Materiales y métodos
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
46
el análisis cualitativo; y el límite de cuantificación que es la menor concentración o
cantidad de analito de una muestra que puede ser determinada con aceptable precisión y
exactitud bajo las condiciones experimentales establecidas.
Para la determinación del límite de detección en el procedimiento de análisis se analizó el
blanco siguiendo la técnica descrita en el epígrafe II.4.1. Para cada uno de los
procedimientos, se realizaron tres determinaciones.
En todos los casos se calcularon los límites de detección (LD) como la concentración de
analito que produce una señal igual a tres veces la desviación estándar del blanco (criterio
3σ de la IUPAC) (Thompson, 1995A y 1999; ICH, 1995) bajo las condiciones
experimentales óptimas.
Se tomó como límite de cuantificación (LC) la concentración de analito que produce una
señal igual a diez veces la desviación estándar del blanco (Thompson, 1995A y 1999;
ICH, 1995; Eurachem, 1998) bajo las condiciones experimentales óptimas.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
47
Capítulo III. Análisis y Discusión de los Resultados.
III.1- Metodología de extracción para la obtención de partenina.
Teniendo en cuenta la técnica extractiva reportada (Acosta I., 1999), se desarrolló el
aislamiento y la obtención de la partenina.
El seguimiento cromatográfico de las fracciones clorofórmicas obtenidas, demostró la
presencia del componente de interés, lo cual coincide con lo reportado (Acosta I., 1999;
Correia P., 2003). De ello se determinó que el extracto clorofórmico respecto a la mezcla
metanol-agua, contiene el componente de interés en mayor proporción, visualizado por la
intensidad en la coloración de la mancha, al ser punteado y comparado con el patrón de
análisis, bajo las mismas condiciones cromatográficas.
III.2- Aislamiento y elucidación estructural de la partenina.
Se desarrolló la metodología extractiva y el procedimiento de cristalización (Ranjit, S. D.
1994; Acosta I., 1999), con las modificaciones referidas en el epígrafe II.3, obteniéndose
cristales en forma de agujas, sumergidos en un aceite amarillento, (Domínguez, X. A.,
1970). [Se desarrollaron sucesivas recristalizaciones (Domínguez, X. A., 1970).]
Como criterio de pureza del producto obtenido, se registró una temperatura de fusión en
el intervalo de 161 - 163˚C.
El ensayo cromatográfico en capa delgada (CCD) del compuesto aislado, que se propone
corresponde a la estructura química de la partenina, evidenció una sola mancha sin colas,

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
48
ni frentes difusos de color primero amarillo y luego violeta, a un valor de Rf que oscila en
el intervalo de 0,58-0,64 semejante al obtenido para el patrón bajo las mismas
condiciones cromatográficas. Tal comportamiento coincide con los reportes de la
literatura especializada. (Pickman, A.K.; Towers, G.H.N; 1980). (Figura 1).
M 3 4 5 6 7 8 9 10 11 P M 3 4 5 6 7 8 9 10 11 P Revelador: Lámpara UV a λ=254 nm Revelador: Reactivo vainillina Fig. 1. Cromatogramas de capa delgada obtenidos para el patrón analítico y las
fracciones del extracto vegetal obtenidas por elusión en columna.
Los resultados en el desarrollo del espectro UV en metanol del compuesto obtenido, en
comparación con el espectro de la muestra vegetal, corrobora las bandas descritas para
este componente, obteniéndose un máximo de absorción a 210 nm correspondiente a la
transición de origen (π-π*). (Figura 2).

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
49
Espectro UV para muestra y patrón (200-300 nm)
0
0.20.4
0.60.8
11.2
200 215 239 254 269 284 299
Longitud de onda
Abs
orba
ncia Espectro
patrónEspectromuestra
Fig. 2. Espectro UV en metanol, de la muestra y del patrón obtenido a partir de la
metodología de extracción recomendada. Por CLAE se evidenció un pico estrecho con buena resolución que eluye a un tiempo de
retención (tr) de 5,3 minutos, semejante al obtenido para el patrón de análisis bajo las
mismas condiciones cromatográficas.
Los resultados obtenidos en la caracterización estructural del producto obtenido por la
metodología de extracción propuesta evidencian en el análisis del espectro
RMN las siguientes señales: presencia de protones vinílicos (doblete desde 7.595 y 7.610
ppm) correspondiente a protones de C-2, asociado con el sistema ciclopentanona, referido
a 7.665 ppm. Aparece un doblete en el C-13 desde 6.207 y 6.213 ppm reportándose en la
literatura a una señal de 6.14 ppm y otro desde 6.102 y 6.117 ppm correspondiente a una
señal de 5.62 ppm (Nogueiras, C., 1996) lo cual explica la presencia de una γ-lactona
conjugada con un grupo metilen-hexocíclico. La señal del protón en C-6 refiere la
literatura que debe aparecer con un doblete a 5.04 ppm, por estar unido a un heteroátomo
en efecto desblindante, obteniéndose experimentalmente un doblete desde 4.955 y 4.975.
(Anexos I y III).

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
50
El espectro RMN C13 desacoplado de banda ancha mostró un singuleto en el C13
correspondiente a 122.337 ppm, siendo la deducción teórica de 121.4 ppm. Aparece en
C-2 un singuleto a 142.332 ppm en comparación con el valor reportado de 145.3 ppm. En
el C-3 se observa un singuleto a 131.718 ppm reportándose bibliográficamente a 128.7
ppm. Todos estos carbonos se encuentran sustituidos en posición ipso. (Nogueiras, C.,
1996). (Anexos II y IV).
III.3- Desarrollo y validación de técnicas analíticas. III.3.1- Desarrollo y validación de la técnica analítica para la determinación cuantitativa de partenina en extractos de Parthenium hysterophorus, L. mediante Cromatografía Líquida de Alta Eficacia. (CLAE). Se desarrolló, bajo las condiciones de análisis especificadas en Materiales y Métodos, la
determinación de la concentración de partenina en el material vegetal, correspondiente a
4,71 %.
Resultados de la Validación.
III.3.1.1- Linealidad.
Según el análisis de las tres réplicas realizadas a las curvas de calibración en el intervalo
de concentraciones de 0,05 a 0,25 mg/mL (50 a 250 mg/ L), se obtuvo el siguiente
modelo matemático:
y = 13,654 x – 0,4017

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
51
Donde:
x: concentración de analito en mg/ L
y: respuesta (área bajo la curva)
Fig. 3. Representación gráfica del comportamiento lineal de la partenina.
A través de los cálculos estadísticos realizados, partiendo de la regresión lineal, se
obtuvieron los datos de la Tabla 1.
Tabla 1: Resultados de la linealidad.
r CVf % Sbrel % a±Sat
Valor calculado 0,9977 4,32 1,82 -90,05 a 89,25
Criterio > 0,9900 < 5,00 < 2,00 Contener el 0

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
52
Donde:
r: coeficiente de correlación lineal.
CVf: coeficiente de variación de los factores respuesta.
Sbrel: desviación estándar relativa de la pendiente.
a±Sat: límites de confianza del término independiente.
Se puede observar en la tabla que todos los resultados cumplen con lo establecido para
este parámetro, por lo que la técnica es lineal.
III.3.1.2- Precisión.
a) Repetibilidad.
Se determinó coeficiente de variación (%) de los valores de concentración de partenina
(Tabla 2 ), obtenidos según técnica descrita en Materiales y Métodos, el cual fue de 1,08
%. Este valor es inferior al límite máximo establecido para este tipo de muestra, de
acuerdo a lo reportado por Kolthoff (1-5 %) y por Horwitz (2,8 - 4%).
El cromatograma obtenido bajo las condiciones de análisis seleccionadas se muestra en la
figura 4.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
53
Tabla 2: Valores de tiempo de retención (tr), concentración (%) y área bajo la curva
obtenidos para las diferentes réplicas en el ensayo de repetibilidad por CLAE.
Réplicas tr Concentración (%) Área
5,2 4,71 1456,3 1
5,7 4,66 1435,2
5,2 4,66 1445,7 2
5,4 4,71 1451,9
5,4 4,80 1475,7 3
5,4 4,71 1457,3
Fig. 3. Cromatograma CLAE obtenido para la muestra en el desarrollo del ensayo
de repetibilidad.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
54
b) Precisión Intermedia.
Se determinó coeficiente de variación (%) de los valores de concentración de partenina
(Tabla 3), obtenidos por el procesamiento establecido (diferentes días, un analista), el
cual es de 1,39 %, lo cual como puede apreciarse no excede el doble de la repetibilidad.
Tabla 3: Valores de concentración (%) para las réplicas analizadas en el ensayo de
precisión intermedia por CLAE, en días diferentes desarrollados por un analista.
Día 1
Concentración (%)
Día 2
Concentración (%)
Día 3
Concentración (%)
4,71 4,66 4,66
4,66 4,66 4,80
4,71 4,71 4,84
4,84 4,84 4,75
4,8 4,71 4,66
4,71 4,71 4,75
Límites de Confianza de la media:
nStx ⋅
±−
[41]
GL=n-1= 18-1=17
t student (tablas) = 2,110
p=0,05 (95%)
x−
= 4,73
S= 0,0696

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
55
El intervalo de confianza de la media indica que el contenido medio de partenina en el
material vegetal se encuentra con una probabilidad del 95 % entre 4,69-4,76 %.
Análisis de Varianza de la F- fischer:
Para realizar este análisis se comparó los valores de la F- fischer calculada y crítica, con
una probabilidad (p) de 0,7523.
fischerFfischerF críticacalc −− <.
[41]
= 0,29004 fischerF calc− .
= 3,682320 fischerF crítica−
Como puede apreciarse, no existen diferencias significativas entre la determinación
realizada en días diferentes.
Índice de Cochran:
Para su determinación se comparó los valores de CCochran y Ccrítica
CC críticaCochran <[41]
CCochran = 0,31963
Ccrítica = 0,707
Como puede apreciarse, no existen diferencias significativas entre la determinación
realizada en días diferentes.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
56
Por todo lo planteado anteriormente, el método puede ser preciso cuando se cumple que:
CVCV Horwitzdíasentre < [41]
2 log5.01 ⎟⎟⎠
⎞⎜⎜⎝
⎛−
−
= C
HorwitzCV [41]
−
C : valor de concentración media expresada en %
100⋅= −
xS
CVdíasentre
díasentre
díasentre
[41]
( )SSSS repet
repetprec
díasentre
n ...int. +
−= [41]
n: número de mediciones por días
El valor de CV = 0,61 y para CV = 3,17 díasentre Horwitz
Donde:
34,1066,0
73,4
029,0
454,1
==
=
=
=
−
−
CVS
X
SCV
gruposentre
gruposdentro
El estudio de los parámetros anteriores mostró que la técnica es precisa.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
57
III.3.1.3- Exactitud.
Según el método de adición de estándares la recuperación obtenida fue de 98,8 % en
correspondencia con la pendiente de la curva de recuperación que sigue el siguiente
modelo matemático:
y = 0,9876 x + 0,8795
Fig. 4. Dependencia lineal entre la concentración añadida y recuperada de analito patrón.
De acuerdo a la complejidad de la matríz que se analiza y del procedimiento extractivo, la
recuperación de la técnica se considera aceptable, reportándose un por ciento de
recuperación dentro del intervalo de aceptación para técnicas cromatográficas entre un
98- 102,0 %. De esta forma puede decirse que el método es exacto, teniendo la capacidad
de dar resultados los más próximos posible al valor verdadero.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
58
Para confirmarla, se aplica un test de t de student, mediante la siguiente ecuación:
CV
nRt
−
−=
100
exp[38]
ttablas= 2,365 texp= 1,01
p=0,05 (95 %)
GL=n-1= 8-1= 7
Al ser t exp< ttab no existe diferencias significativas entre recuperación media y 100, por lo
que el método es exacto.
III.3.1.4- Especificidad.
Se analizaron comparativamente los cromatogramas obtenidos para la partenina patrón y
para la muestra, registrados bajo las mismas condiciones de análisis, observándose que
no hay sustancias en la muestra que interfieran en la determinación de la partenina.
Además, ambos picos, de patrón y muestra, presentan la misma simetría correspondiente
a un valor de 0,7 y semejante ancho en la semialtura, por lo que pueden superponerse, lo
que descarta posibles solapamientos. (Fig. 5 y 6).

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
59
Fig. 5. Cromatograma CLAE obtenido para el patrón de análisis bajo las condiciones experimentales establecidas.
Fig. 6. Cromatograma CLAE obtenido para la muestra de análisis bajo las
condiciones experimentales establecidas.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
60
Para comparar los factores de simetría de los picos para el patrón y la muestra, se
calcularon los intervalos de confianza de dichos factores, de forma tal que unos
intervalos incluyan a los otros. Para el patrón estos intervalos van desde 0,6969 hasta
0,7030 y en el caso de la muestra los intervalos oscilan desde 0,6977 hasta 0,7022.
Límite de Confianza para los factores de simetría:
nStx ⋅
±−
[41]
Patrón Muestra
x−
= 0,70 = 0,70 x−
t = 2,365 t = 2,365
S = 0,0103 S = 0,0075
n = 8 n = 8
Por lo tanto, la técnica se considera específica.
III.3.1.5- Sensibilidad.
La determinación de los límites de detección (LD) y de cuantificación (LC), fue
desarrollada siguiendo el procedimiento de análisis descrito en el apartado referente a
Sensibilidad de Materiales y métodos.

Capítulo III. Análisis y Discusión de los Resultados
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
61
Se determinó el límite de detección equivalente a la mínima concentración detectable por
la técnica analítica con suficiente certeza y confiabilidad, correspondiente a un valor de
0,76 mg/ L.
El límite de cuantificación fue establecido a partir de la determinación de la mínima
cantidad cuantificable con una adecuada precisión para un valor de 2,49 mg/ L.
Teniendo en cuenta el cumplimiento de todos los parámetros de desempeño
determinados, la técnica analítica es fiable.

Conclusiones
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
62
Conclusiones.
La metodología de aislamiento de la partenina, a partir de los sólidos
pulverulentos de la planta, es idónea y factible de aplicar en la
obtención del ingrediente principal con vistas a su utilización como
patrón analítico.
La partenina aislada fue caracterizada mediante la Cromatografía en
Capa Delgada (CCD) y mediante técnicas espectroscópicas (Resonancia
protónica y C13), complementándose la caracterización estructural del
producto.
Se desarrolló y validó la Cromatografía Líquida de Alta Eficacia
(CLAE) como técnica de análisis aplicable en la determinación
cuantitativa de la partenina en los sólidos pulverulentos de Parthenium
hysterophorus, Linn.

Recomendaciones
Aislamiento, caracterización y cuantificación de la partenina en los sólidos
pulverulentos de Parthenium hysterophorus, L.
63
Recomendaciones. 1. Se sugiere complementar la evaluación de pureza de la partenina aislada a
través de la implementación de una técnica de análisis cuantitativo.
2. Proponer las especificaciones de calidad de la partenina obtenida con vistas
a su empleo como patrón analítico.
3. Se recomienda aplicar la técnica cromatográfica de análisis (CLAE) en el
control de la calidad de la forma sólida de dosificación propuesta en
trabajos de investigación colaterales.

Bibliografía
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
64
Bibliografía.
1. Etile, D. Spegazzini y Najera, M. T.: Etnofarmacobotánica de los “ajenjos” de la
medicina popular Argentina. Datos morfológicos para su reconocimiento. Acta
Farm. Bonaerensse, vol.3: 153-60, 1984.
2. Roig, J. T: Diccionario botánico de nombres vulgares cubanos. La Habana:
Editorial Nacional de Cuba, 1975.
3. Shelke D.K. 1984. Parthenium and its control – a review. Pesticides 18:51-54.
Srivastava J. N., J. P. Shukla y R.C.
4. Carvajal, D.; Arruzabala, A: Evaluación farmacológica de extractos de plantas
con reportes en la medicina popular como cardiotónicos, hipotensores y
antiasmáticos. Revista de plantas medicinales, vol. 3, p.15, 1983.
5. Roig, J. T.: Plantas medicinales, aromáticas o venenosas de Cuba. Instituto del
Libro. La Habana. Editorial Ciencia y Técnica: 354-356, 1974.
6. House et al: plantas medicinales communes de Honduras. Parthenium
hysterophorus: 319, 1995.
7. Marchand, Bernard; Bell, Mojand y Rodríguez, Eloy: Application of High-
Performarce Liquid chromatography of analisis and isolation of sesquiterpene
lactones. Journal of chromatography, vol. 265:97-104, 1983.

Bibliografía
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
65
8. Sethi, V. K; Kould, S. K; Taneja, S. C. y Dhar, K. L.: Minor sesquiterpene of
flowers of Parthenium hysterophorus L.. Fitochemitry, vol.26 (12): 3359-3361,
1987.
9. Cuéllar, C. A.: Química de los fármacos naturales, 1983.
10. Gupta, R.: Chemical investigation of Parthenium hysterophorus L. Indian Journal
Pharm., vol. 39: 64-66, Indian, 1977.
11. Gary, O. y Plasencia, V.: Tesis “Evaluación fotoquímica y biológica de los
extractos de las hojas de Parthenium hysterophorus L.”, 1998.
12. Sharma, S. K.; Sing, V. P.: The antifungal activity of some essential oils. Indian
drugs Pharm. Ind., vol.4 (1): 3-6, 1979.
13. Cuéllar, C. A.: Farmacognosia y productos naturales, 2001.
14. Acuña, Galé J.: Plantas identificadas en los cultivos cubanos. Consejo editorial de
la Academia de Ciencias de Cuba; p. 240, 1974.
15. Fitomed II, MINSAP. Edición Ciencias Médicas, 1993.
16. Robineau, L: Hacia una farmacopea caribeña. Seminario Tramil 5 y 6, 1990-1992.
17. From DNP on CD-ROM, Version 14.1. Copyright © 1982-2006 Chapman &
Hall/CRC.

Bibliografía
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
66
18. Pretsch, E.; Bühlmann, P.; Affolter, C. Structure Determination of Organic
Compounds. Tables of Spectral Data. 3rd Completely Revised and Enlarged
English Edition., Springer-Verlag, Berlin, 2000.
19. Srivastava 1985. Effect of Parthenium hystrophorus L. extract on the seed
germination and seedling growth of barley, pea and wheat. Acta Botánica Indica
13: 194-197.
20. Romo de Vivar. Productos naturales de la flora mexicana, 1975.
21. Ranjit, S. Dhillon; Kaushal, Nayyar y Swarajet, Sinagh. Indian journal of
chemistry, vol. 33B (11), Nov 1994.
22. Nogueiras, C.: Tesis “Identificación y caracterización de la partenina principal
lactona de Parthenium hystrohporus L.”, 1996.
23. Domínguez, X.A. y Sierra, Antolín: Isolation of a new diterpene alcohol and
parthenin from Parthenium hysterophorus, 1970.
24. Pickman, Anna K.; Panfil, Irma y Towers, G.H. Neil: Separation and
identification of estereoisomers of sesquiterpene lactones by multipledevelopment
of Thin-Layer Chromatography. Journal of chromatography, vol. 212:379-381,
1981.
25. Rodríguez, E: Ecogeographic distribution of secondary contituens in Parthenium
(Compasitae). Biochem. Syst. Ecol. (USA), vol. 5:507, 1977.

Bibliografía
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
67
26. Toebes AH; De Boer V; Verkieij JA; Lingeman H; Ernst WH. Extraction of
isiflavone malonylglucosides from Trifolium pratense L. J Agric Food Chem.
2005 Jun 15;53(12):4660-6.
27. USP XXIII, 1995, Farmacopeas: Británica, 1998; Española, 1995.
28. Center for drug evaluation and research (CDER): “Validation of chromatographic
methods”. Reviewer Guidance; p. 5-10, 1994.
29. I. Merfort, I. J. Chromatography A 967 (2002):115-130.
30. Skoog, Douglas A. y Leary, James J.: Análisis Instrumental. Cuarta edición, p. (5-
10), (184-185), (323-339), (697-699), (771-775), Universidad de Barcelona, 1995.
31. Randerath, K.: Cromatografía de capa fina; Enciclopedia de la química industrial,
tomo 8, Ediciones URMO, SA., p. (4-7) (68-77), 1970.
32. Sueiro, M. L. y García, A.: Tesis “Evaluación analítica y tecnológica de los
sólidos pulverulentos y granulados de Allium sativum L. Formulación en la forma
farmacéutica cápsula”, 1997.
33. Pickman, A.K.; Towers, G.H.N. y Lam, J. Journal of chromatography, vol.189
(2):187-198, 1980.
34. Browning, D.R.: Cromatografía de capa fina; Enciclopedia de la química
industrial, tomo 8, Ediciones URMO, SA., p. (4-7) (68-77), 1970.
35. Valdés, R.: Métodos analíticos cromatográficos. Ciudad de La Habana, 1994.

Bibliografía
Aislamiento, caracterización y cuantificación de la partenina en los sólidos pulverulentos de Parthenium hysterophorus, L.
68
36. Pradeau.: Análisis Químico Farmacéutico de Medicamentos. p.(405), 1998.
37. Saucedo Hernández Yanelis. Tesis de yanelis. Tesis de Maestría. Universidad de
la Habana. 1999.
38. Castro, M. et al: Validación de métodos analíticos. Asociación Española de
Farmacéuticos de la Industria; p. 4-55, Barcelona, 1989.
39. EURACHEM Guide (1998) “The Fitness for Purpose of Analytical Methods. A
Laboratory Guide to Method Validation and Related Topics”. ISBN: 0-948926-
12-0. Reino Unido.
40. Olga Lock de Ugaz. Investigación Fotoquímica, métodos en el estudio de
productos naturales. Pontificia Universidad Católica del Perú. Fondo editorial
1988.
41. Apers, S. et al: Validation of Physicochemical methods, version 4.00. Bélgica,
Febrero 2003.
Related Documents