PROSES INDUSTRI KIMIA II NITRASI Disusun Oleh: Belda Amelia J. (125061100111030) Ulvatus Sa’diyah (125061100111032) TEKNIK KIMIA

Welcome message from author
This document is posted to help you gain knowledge. Please leave a comment to let me know what you think about it! Share it to your friends and learn new things together.
Transcript
PROSES INDUSTRI KIMIA IINITRASI
Disusun Oleh:
Belda Amelia J.(125061100111030)Ulvatus Sadiyah(125061100111032)
TEKNIK KIMIAUNIVERSITAS BRAWIJAYAMALANG2014
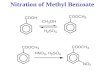
Pengertian NitrasiNitrasi diartikan sebagai reaksi terbentuknya senyawa nitro atau masuknya gugus nitro pada suatu senyawa. Biasanya dilakukan dengan campuran asam sulfat dan asam nitrat atau yang biasa disebut dengan mixed acid. Guna asam asam sulfat dalam nitrasi ini adalah sebagai zat penarik air (pada reaksi nitrasi akan terbentuk air), sehingga reaksi berlangsung sampai berakhir. Nitrasi merupakan reaksi isotermis, yaitu reaksi yang menghasikan zat zat yang dapat meledak.Saat proses nitrasi, gugus nitro akan menggantikan atom monovalen atau beberapa group atom. Pada reaksi nitrasi, gugus nitro dapat berikatan dengan atom yang berbeda, yaitu :a. Gugus nitro yang berikatan dengan atom Karbon (C) akan membentuk senyawa nitroaromatik atau nitroparafinik.b. Gugus nitro yang berikatan dengan atom Oksigen (O) akan membentuk senyawa nitrat esterc. Gugus nitro yang berikatan dengan ataom Nitrogen (N) akan membentuk senyawa nitraminGugus nitro yang berikatan dengan atom hidrogen akan banyak dibahas karena reaksi tersebut merupakan kepentingan teknis yang terbesar. Pada alkil halida tertentu dapat bereaksi dengan perak nitrat dan menghasilkan nitrat ester, atau bereaksi dengan perak nitrit dan menghasilkan suatu senyawa nitro seperti yang ditunjukkan oleh reaksi berikut ini.
Pada jenis nitrasi aromatik yang terjadi pada asam sulfonat atau golongan asetil, gugus nitro dapat melakukan substitusi seperti pada gambar berikut.
Gambar 1. Reaksi nitrasi pada senyawa aromatikNitrasi merupakan suatu reaksi yang sangat penting pada sebuah industri, terutama industri yang bergerak pada bidang kimia organik sintetis. Produk yang banyak dihasilkan dari hasil nitrasi adalah pelarut, pewarna, bahan peledak, dan juga dalam bidang farmasi. Hasil dari reaksi nitrasi juga dapat menghasilkan amina, yaitu dari reaksi reduksi senyawa nitro.
Senyawa PenitrasiBerbagai macam reagen dapat digunakan dalam proses nitrasi. Reagen tersebut adalah asam nitrat (gas, pekat, maupun dalam bentuk larutan), campuran asam nitrat dan asam sulfat (mixed acid), asetat anihidrida, asam asetat, asam fosfat, dan kloroform. Nitrogen pentaoksida (N2O5) dan nitrogen tetraoksida (N2O4) juga digunakan dalam reaksi nitrasi dalam fasa gas.Mixed acid adalah media nitrasi yang paling penting dan mungkin juga media yang paling baik diantara semua media penitrasi lainnya. Penelitian menyebutkan bahwa terdapat asam nitrat berbentuk ion Nitril (NO2+) di dalam asam sulfat. Reaksi ionisasi asam nitrat dapat dituliskan dalam persamaan berikut.
Larutan asam nitrat memiliki tiga jenis spektrum penyerap ultraviolet yang berbeda. Pada larutan yang encer, spektrum muncul karena adanya ion nitrat (NO3-). Pada pelarut polar inert yang lemah seperti kloroform, spektrumnya sama dengan etil nitrat, menunjukkan bahwa terdapat kandungan asam nitrat dalam bentuk HNO3 yang belum terionisasi. Spektrum jenis ketiga adalah karakteristik dari larutan asam sulfat dari asam nitrat dan esternya, menunjukkan bahwa tidak ada kandungan asam nitrat, baik dalam bentuk ion nitrat maupun dalam bentuk HNO3 yang belum terionisasi.Ion yang berasal dari asam nitrat pada asam sulfat memiliki muatan positif. Hal tersebut telah dibuktikan dengan percobaan elektrolisis. Dari percobaan elektrolisis tersebut ditemukan bahwa asam nitrat bergerak dari anoda ke katoda.Hubungan antara jumlah air yang terdapat dalam asam sulfat dengan persen molekul asam nitrat yang terionisasi untuk membentuk ion nitril terdapat pada grafik berikut.
Gambar 2.Efek kandungan air pada ionisasi asam nitrat pada asam sulfat
Berdasarkan grafik pada gambar 2, saat konsentrasi asam sulfat kurang dari 86%, ionisasi asam nitrat yang terjadi sangat sedikit tetapi terus meningkat dengan cepat seiring dengan konsentrasi asam sulfat yang semakin besar. Pada konsentrasi asam sulfat sebesar 94%, asam nitrat telah terionisasi sempurna menjadi ion nitril. Nitrasi AromatikNitrasi senyawa aromatik dapat digambarkan dengan persamaan sebagai berikut.
Senyawa penitrasi merupakan reaktan yang bersifat elektrofilik, yaitu sifat suatu senyawa yang memiliki kecenderungan untuk menyukai elektron karena senyawa itu sendiri kekurangan elektron . Reaksi akan terjadi pada atom karbon di dalam cincin aromatik dimana kerapatan elektronnya paling besar. Gugus nitro dapat masuk pada posisi ortho, meta, atau para (sebagai isomernya). Proporsi dari produk isomer ini bergantung pada jenis substituennya karena substituen memiliki efek yang besar pada kerapatan elektron di sekitar atom karbon. Perbandingan proporsi ortho, meta, dan para dari berbagai substituen terdapat pada tabel berikut.
Pada tabel di atas terlihat bahwa proporsi ortho, meta, dan para berbeda setiap substituennya.
Nitrasi Naftalena dan AnthraquinonPada reaksi nitrasi naftalena, sebanyak dua buah gugus nitro memungkinkan untuk masuk ke dalam cincin aromatik dan membentuk 1-nitronaftalena dan 2-nitronaftalena. Saat nitrasi, gugus nitro yang pertama akan masuk ke posisi alfa () atau posisi 1, sedangkan gugus nitro yang kedua akan masuk ke posisi 5 atau 8.
Pada reaksi nitrasi anthraquinon, gugus nitro yang memungkinakan untuk masuk ke dalam cincin aromatik adalah sebanyak tiga buah (dengan menggunakan mixed acid). Produk yang dihasilkan adalah 1-nitroanthraquinon, 1,5-dinitroanthraquinon, dan 1,8-dinitroanthraquinon.
Teori Substitusi Aromatik Substituen dapat mempengaruhi kerapatan elektron dengan menggunakan dua jenis efek, yaitu efek Induktif (I) dan efek Mesomeri (M). Terdapat dua jenis efek induktif, yaitu efek I yang menarik elektron dan efek +I yang menolak elektron. Hal yang sama juga terjadi pada efek Mesomeri (M dan +M). Efek induktif sangat berkaitan dengan momen dipol dari senyawa, seperti C6H5 X. Jika X berada pada dipol/kutub negatif, maka X tersebut akan menarik elektron keluar cincin dan efek yang timbul adalah efek I. Jika X berada pada kutub positif, maka kerapatan elektron pada cincin aromatik akan bertambah karena elektron tidak keluar dari cincin, sehingga efek yang timbul adalah efek +I. Gugus yang menghasilkan efek I adalah Nme3+, NO2, COOEt, dan halogen. Gugus yang menghasilkan efek +I adalah O- dan beberapa jenis alkil. Efek +I mengakibatkan seluruh posisi di dalam cincin semakin reaktif dan semakin kuat daripada posisi pada benzena yang belum tersubstitusi, sehingga posisi ortho dan para akan lebih reaktif daripada posisi meta. Efek I akan menurunkan tingkat reaktivitas dari seluruh posisi pada cincin benzena. Akan tetapi, efek penurunan reaktivitas tersebut berpengaruh lebih besar pada posisi ortho dan para, sehingga posisi meta lebih reaktif. Jenis substituen yang memiliki elektron bebas dapat meningkatkan kerapatan elektron dalam cincin aromatik karena efek mesomeri +M. Jenis substituen lainnya dapat menurunkan kerapatan elektron dalam cincin aromatik karena efek M. Ilustrasi dari efek mesomeri yaitu sebagai berikut.
ba
Gambar a menunjukkan efek mesomeri +M karena terjadi perpindahan elektron dari substituen menuju cincin aromatik. Perpindahan tersebut akan menyebabkan cincin aromatik akan semakin kuat pada posisi orto dan para daripada posisi meta. Gambar b menunjukkan efek mesomeri M karena terjadi perpindahan elektron keluar dari cincin aromatik menuju substituen. Perpindahan tersebut akan menyebabkan seluruh posisi dalam cincin terdeaktivasi, tetapi posisi meta lebih sedikit terkena deaktivasi tersebut. Group yang menunjukkan efek +I dan +M pasti tersubstitusi pada posisi ortho dan para, sedangkan group yang menunjukkan efek I akan mengakibatkan proses substitusi menjadi lebih sulit sehingga akan lebih dominan ke posisi met.a Ketika dua efek yang bertentangan direaksikan, maka produk yang dihasilkan akan lebih sulit diprediksi. Efek bertentangan tersebut contohnya efek +I dan M serta I dan +M.
Rasio Ortho : ParaEfek substituen terhadap rasio ortho:para dapat dipengaruhi oleh faktor lain, seperti faktor sterik (ukuran substituen). Semakin besar ukuran substituen, maka semakin sulit pula untuk mencapai posisi ortho dan rasio produk ortho:para juga semakin kecil. Contoh yang dapat diambil adalah proses mononitrasi alkilbenzena seperti yang ditunjukkan pada tabel berikut.
Tabel diatas menunjukkan bahwa semakin besar ukuran substituen, maka kemungkinan untuk berada di posisi ortho atau para akan semakin kecil dan rasio ortho:para akan menurun.Faktor lain yang dapat mempengaruhi rasio ortho:para adalah efek I dan M seperti yang dijelaskan pada bagian sebelumnya. Efek induktif akan bekerja lebih kuat pada posisi ortho daripada posisi para, sedangkan efek mesomeri akan lebih kuat pada posisi para daripada posisi ortho. Senyawa yang memiliki efek +I, akan menghasilkan rasio yield ortho:para yang lebih besar daripada senyawa yang memiliki dominan efek + M. Begitu juga dengan senyawa yang efek dominannya adalah I akan menghasilkan rasio yield ortho:para yang lebih kecil daripada senyawa yang memiliki dominan efek M.Rasio ortho:para juga dipengaruhi oleh media nitrasinya. Distribusi isomer yang hasilnya berasal dari nitrasi anilina dan anilida pada beberapa macam media terdapat pada tabel berikut.
Nitrasi asetalinida dengan senyawa penitrasi mixed acid menghasilkan nitroasetanilida dengan rasio ortho:para kurang dari 0,1. Ketika medium nitrasinya dalam asam nitrat, rasio ortho:para nya sebesar 0,7, dan ketika medium yang digunakan adalah asetil nitrat di dalam asetat anihidrida, produk seluruhnya adalah o-nitroasetanilida. Pada asam kuat (asam nitrat dan asam sulfat), aniline sangat terionisasi. Persamaan reaksinya adalah sebagai berikut.
Ion anilium (C6H5NH3+) akan terdeaktivasi karena efek I pada substituen NH3+. Nitrasi tersebut akan menghasilkan isomer pada posisi meta. Senyawa amina bebas akan teraktivasi karena efek +M dari group NH2- sehingga menghasilkan isomer posisi para. Pada lingkungan asam lemah seperti asam asetat, konsentrasi ion anilium lebih sedikit daripada asam kuat.Kinetik dan Mekanisme Nitrasi AromatikKinetika reaksi nitrasi bergantung pada media reaksinya. Misalnya reaksi terjadi pada asam sulfat. Senyawa yang mengalami nitrasi pada keadaan tersebut adalah senyawa yang memiliki efek efek I dan efek M yang kuat seperti nitrobenzena, anthraquinon, dan etil benzoat. Laju dari nitrasi tersebut sebanding dengan konsentrasi asam nitrat dan substrat organik lain yang ditambahkan. Laju reaksinya adalah sebagai berikut.
Efek dari kandungan air pada proses nitrasi ditunjukkan oleh grafik di bawah ini.
Gambar 3.Efek kandungan air pada nitrasi dan ionisasi trifenil karbinol
Laju reaksi akan meningkat dengan tajam seiring dengan meninggkatnya konsentrasi asam sulfat dan mencapai titik maksimum pada saat konsentrasi asam sulfat sebesar 90%. Akan tetapi, laju reaksinya menurun drastis pada saat konsentrasi asam sulfat lebih dari 90%. Kenaikan laju reaksi disebabkan karena naiknya konsentrasi ion nitril yang terbentuk. Grafik tersebut juga menunjukkan konstanta kesetimbangan (k) dari tris p-nitrofenilkarbinol meningkat seiring dengan meningkatnya laju reaksi. Trifenilkarbinol akan mengalami ionisasi dalam asam sulfat dan menghasilkan ion karbonium seperti yang terjadi pada ionisasi asam nitrat yang menghasilkan ion nitril. Reaksi yang terjadi adalah :
Sesuai dengan grafik pada gambar 3, laju reaksi nitrasi akan menurun pada saat konsentrasi asam sulfat di atas 90%. Penyebabnya adalah adanya interaksi antara substrat organik dan asam sulfat sehingga akan menurunkan kerapatan elektron di dalam cincin. Penurunan kerapatan elektron tersebut akan mengakibatkan berkurangnya reaktivitas dari cincin tersebut. Kemungkinan interaksi yang terjadi adalah pembentukan ikatan Hidrogen antara nitrobenzena dan asam sulfat. Kekuatan ikatan tersebut akan semakin kuat pada keadaan asam (dalam hal ini adalah asam sulfat). Berkurangnya kandungan air pada asam sulfat (kenaikan konsentrasi asam sulfat) akan meningkatkan interaksi yang semakin kuat antara asam dan substrat organik sehingga elektron akan semakin keluar dari cincin. Keluarnya elektron tersebut mengakibatkan laju reaksi nitrasi menurun.
Nitrasi pada Pelarut OrganikPada pelarut organik seperti nitrometana atau asam asetat, proses kinetika nitrasinya bergantung pada senyawa aromatik yang akan dinitrasi. Senyawa seperti nitrobenzena atau etil benzoat yang merupakan group pendeaktivasi, akan dinitrasi pada laju yang sebanding dengan konsentrasi substratnya (reaksi orde satu). Senyawa yang lebih reaktif dari benzena (toluen, xilene, p-kloranisol) akan bereaksi pada laju yang berbeda dengan substratnya (reaksi orde nol). Mekanisme pembentukan ion nitril adalah sebagai berikut.
Langkah pertama yaitu proses transfer proton dari satu molekul asam nitrat ke molekul asam nitrat lainnya dengan sangat cepat. Laju reaksi langkah kedua, yaitu pembentukan ion nitril, bergantung kepada media yang digunakan. Pada asam kuat, pelarut yang sangat polar (asam sulfat pekat), reaksi akan berjalan sangat cepat. Sebaliknya, pada asam yang relatif lemah seperti asam asetat atau nitrometana, reaksi tersebut akan berjalan lambat.
Nitrasi pada Larutan Asam NitratSubstrat yang sangat reaktif akan menunjukkan reaksi berorde nol, sedangkan senyawa yang kurang reaktif akan menunjukkan reaksi berorde satu (pada 40% larutan asam nitrat). Laju reaksi nitrasi dari senyawa reaktif akan sama dengan laju pertukaran O18 antara HNO318 dan H2O16. Pertukaran oksigen anatara asam nitrat dan air terjadi pada reaksi berikut ini :
ion nitril yang terbentuk akan segera bereaksi dengan air
Efek Asam Nitrit pada NitrasiAsam nitrit (HNO2) atau nitrogen dioksida (NO2) dapat menghambat reaksi (inhibitor), dan dapat juga mempercepat reaksi (katalis). Efek mengsihambat terjadi ketika nitrasi terjadi pada senyawa yang tidak memiliki gugus pengaktivasi, yang reaksinya menggunakan medium asam nitrat kuat atau mixed acid. Pada media tersebut asam nitrit akan membentuk ion nitrosil (NO+).
Ion nitrosil yang terbentuk akan mengurangi konsentrasi ion nitril sehingga menurunkan laju reaksinya. Efek mempercepat reaksi terjadi pada nitrasi substrat reaktif seperti anisol atau dimetianilina, yang reaksinya menggunakan asam nitrat lemah (konsentrasi ion nitril rendah). Efek katalitik muncul karena pembentukan senyawa nitroso yang teroksidasi menjadi senyawa nitro. Mekanismenya adalah.
Ion nitrosil bersifat lebih lemah daripada ion nitril, sehingga ion tersebut hanya dapat bereaksi dengan senyawa aromatik yang sangat reaktif seperti anisol atau dimetilanilina. Syarat yang harus terpenuhi agar asam nitrit bisa menyebabkan reaksi katalitik adalah :a. Substrat yang digunakan harus cukup reaktif, sehingga ion nitrosil bisa menyerang dengan mudahb. Media reaksi harus memiliki konsentrasi ion nitril yang rendah, sehingga ion nitrosil dapat berkompetisi dengan ion nitril secarasetara untuk berikatan dengan substratOksinitrasiOksinitrasi adalah reaksi yang terjadi antara benzena dan sekitar 50% asam nitrat yang mengandung 0,2 molar merkuri nitrat. Hasil dari reaksi tersebut adalah 85% dinitrofenol dan asam picric. Mekanisme yang terjadi saat oksinitrasi adalah sebagai berikut :
Mula-mula benzena akan dikonversi menjdi fenilmerkuri nitrat yang kemudian akan direaksikan dengan nitrogen dioksida untuk membentuk nitrosobenzena. Nitrosobenzena yang dihasilkan dapat bereaksi dengan dua cara. Pada asam nitrat (50%), nitrosobenzena dikonversi secara langsung menjadi p-nitrofenol tanpa melalui pembentukan senyawa diazonium. P-nitrofenol yang terbentuk kemudia dinitrasi dan menghasilkan dinitrofenol dan asam picric.
Nitrasi pada Senyawa ParafinReaksi Fasa GasTidak seperti nitrasi aromatik yang mudah diserang oleh reagen elektrofilik seperti ion nitril, senyawa parafin memiliki sifat inert kepada reagen tersebut. Senyawa parafin sangat rentan diserang oleh atom tertentu dan radikal bebas. Pada reaksi nitrasi senyawa parafin, ciri-ciri yangterjadi adalah :a. Terdapat temperatur optimum dimana didapatkan yield tertinggi. Dengan menggunakan butana dan asam nitrat pekat (rasio 15:1), waktu kontak sebesar 1,6 detik, hasil nya adalah sebagai berikut
Tabel diatas menunjukkan konversi asam nitrat terbesar pada temperatur 425oC. Pada temperatur 435oC konversi asam nitrat dan yield berdasarkan butana menurun.b. Penambahan oksigen meningkatkan yield berdasarkan asam nitrat tetapi juga menaikkan oksidasi butana. Efek yang ditimbulkan ditunjukkan pada grafik di bawah ini.
Penambahan oksigen juga meningkatkan produksi nitrometana dan nitroetana, tetapi menurunkan produk nitrobutana. Ketika rasio O2:HNO3 = 1, yield berdasarkan butana yang bereaksi meningkat dari 32% ke 45%. Penggunaan uap sebagai pencair dengan bantuan oksigen juga mengurangi efek oksidatif dari oksigen dan membantu meningkatkan konversi.c. Nitrogen bereaksi dengan parafin dan menghasilkan nitroparafin. Pada temperatur 325oC, waktu kontak selama 1,9 menit, rasio propana:NO2 = 4,2, konversi NO2 sebesar 16,6% dan yield berdasarkan mol hidrokarbon sebesar 51%. Penambahan oksigen akan menurunkan temperatur optimum serta meningkatkan konversi dan yield. Pada temperatur 285oC, waktu kontak 3 menit, rasio O2:NO2 = 0,75, konversinya adalah sebesar 29% dan yield sebesar 71%.d. Bromin memiliki efek menguntungkan terhadap konversi dan yield nitroparafin dengan menggunakan asam nitrat. Pada temperatur 423oC, waktu kontak selama 1,5 detik, rasio propana:O2 = 8,2, rasio propana:asam nitrat = 9,9, rasio air:asam nitrat = 15, dan Br2:HNO3 = 0,015, konversi yang terjadi adalah sebesar 55,5%. Produk lainnya yang terbentuk yaitu :CO2 = 0 %CO = 3, 6%C3H6 = 9,7 %C2H4 = 4,1 %aldehida dan keton = 27 %e. Hidrokarbon dengan cabang yang banyak akan mengalami pembelahan yang lebih sedikit daripada isomernya yang bercabang lebih sedikit. Substitusi hidrogen lebih memungkinkan untuk terjadi ketika struktur hidrokarbon bercabang banyak mengalami nitrasi. Perbandingan nitrasi isomer butana dan pentana berdasarkan rasio molar produk yang diakibatkan oleh pembelahan ditunjukkan pada tabel berikut ini
Ketika skeleton karbon lebih semakin bercabang, substitusi hidrogen semakin berkurang.f. Koefisien temperatur untuk substitusi hidrogen berada pada urutan primer > sekunder > tersier. Laju substitusi akan berlawanan pada temperatur yang rendah. Seiring dengan meningkatnya temperatur reaksi, laju reaksinya juga semakin setara
Reaksi Fasa LiquidReaksi ini tidak begitu banyak dilakukan karena yield yang dihasilkan sedikit, konversi yang terjadi rendah, dan munculnya reaksi-reaksi samping yang tidak diinginkan. Prinsip nitrasi liquid ini adalah pergantian atom hidrogen dengan gugus nitro. Reaksi ini berjalan relatif lambat karena kelarutan antara senyawa parafin dan medium nitrasi rendah. Karena titik didih parafin yang lebih tinggi, hidrokarbon bercabang banyak dapat dinitrasi pada temperatur yang tinggi dan reaksi berjalan lebih cepat daripada hidrokarbon yang memiliki berat molekul kecil. Mononitroparafin yang pertama kali terbentuk bersifat lebih larut pada asam nitrat daripada hidrokarbon, sehingga reaksi akan terus berlanjut dan menghasilkan polinitroparafin. Hasil lainnya adalah produk oksidasi berupa asam lemak, alkohol, dan oksida karbon.Ketika parafin bercabang banyak pada fasa liquid dinitrasi dengan asam nitrat pada fasa vapor, reaksi akan berjalan lancar pada temperatur yang rendah. Pencampuran reaktan dicapai dengan cara mengalirkan asam nitrat melalui kumparan yang terhubung dengan senyawa parafin liquid. Liquid parafin dijaga temperaturnya agar tetap diatas 121oC (titik didih maksimum dari 65-70% asam nitrat), sedangkan uap asam yang terbentuk didifusikan melalui plat berpori dan membentuk gelembung. Tabel di bawah ini menunjukkan hasil nitrasi n-dodekana pada suhu 180-190oC dengan menggunakan prosedur yang sama.
Data diatas menunjukkan bahwa rasio asam nitrat:parafin yang besar akan mengakibatkan terbnetuknya senyawa polinitro dan asam lemak dalam jumlah yang besar. ketika rasio parafin:asam nitrat dikurangi menjadi 1:2, hanya 42% parafin yang telah digunakan dan produk utamanya adalah mononitrododekana. Sejumlah parafin (sampai dengan 19%, tergantung pada kondisi) akan rusak karena proses oksidasi.
Nitrasi Olefin Fasa LiquidSenyawa penitrasi yang digunakan biasanya adalah Nitrogen dioksida. Penambahan udara juga dilakukan untuk mengoksidasi senyawa nitrat oksida menjadi dioksida. Produk mula-mula adalah dinitroparafin dan nitronitrit. Senyawa nitronitrit yang tidak stabil akan dioksidasi dengan bantuan udara menjadi senyawa yang lebih stabil, yaitu nitronitrat. Nitronitrit yang tersisa akan dikonversi menjadi nitroalkohol.
Reaksi dilakukan dengan penambahan olefin ke dalam nitogen dioksida secara perlahan pasa temperatur sebesar -10 sampai +25oC. Penggunaan eter sebagai pelarut makan meminimalisisr reaksi samping yang bersifat oksidatif. Reaksi dapat berlangsung selama 1-2 jam. Total yield yang dihasilkan adalah sebesar 65-85%
Related Documents